-
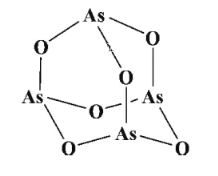
下列物质中都存在离子键、极性键和配位键的是( )
A. 氢氧化钠、过氧化钠、硫酸四氨合铜[Cu(NH3)4]SO4、氢化钠
B. 硝酸铵、氢化铵、氢氧化二氨合银[Ag(NH3)2]OH、硫酸铵
C. 硫酸、氢氧化钠、氮化钙、氢氧化钡
D. 氯化铵、氢氧化钠、双氧水、过氧化钙
难度: 简单查看答案及解析
-
下列电子排布图所表示的元素原子中,其能量处于最低状态的是 ( )
A.
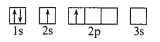 B.
B. 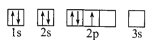
C.
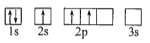 D.
D. 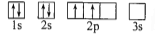
难度: 简单查看答案及解析
-
已知某元素+3价离子的电子排布式为1s22s22p63s23p63d3,该元素在周期表中的位置和区域是( )
A. 第三周期第ⅥB族;p区 B. 第三周期第ⅢB族;ds区
C. 第四周期第ⅥB族;d区 D. 第四周期第ⅢB族;f区
难度: 中等查看答案及解析
-
2001年诺贝尔化学奖授予在“手性碳原子的催化氢化、氧化反应”研究领域作出贡献的美、日三位科学家。下列分子中含手性碳原子的是
A. CHFBr2 B. CH3CH2OH
C.
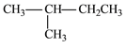 D.
D. 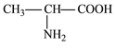
难度: 中等查看答案及解析
-
关于晶体的自范性,下列叙述正确的是( )
A.破损的晶体能够在固态时自动变成规则的多面体
B.缺角的氯化钠晶体在饱和NaCl溶液中慢慢变为完美的立方体块
C.圆形容器中结出的冰是圆形的体现了晶体的自范性
D.由玻璃制成规则的玻璃球体现了晶体的自范性
难度: 中等查看答案及解析
-
下列有关获得晶体的途径,错误的是 ( )
A. 从熔融态结晶出来的硫
B. 熔融态物质急速冷却
C. 凝华得到的碘
D. 从硫酸铜饱和溶液中析出的硫酸铜
难度: 简单查看答案及解析
-
某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未能画出),晶体中A、B、C的原子个数之比为
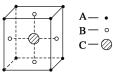
A. 1∶3∶1 B. 2∶3∶1
C. 2∶2∶1 D. 1∶3∶3
难度: 中等查看答案及解析
-
通常状况下,NC13是一种油状液体,其分子空间构型与氨分子相似,下列对NC13的有关叙述正确的是 ( )
A. 分子中N—C1键键长比CCl4分子中C—C1键键长更长
B. 分子中的所有原子均达到8电子稳定结构
C. NCl3分子是非极性分子
D. NBr3比NCl3易挥发
难度: 中等查看答案及解析
-
下列各组中的X和Y两种原子,在元素周期表中一定位于同一族的是( )
A. X原子和Y原子最外层都只有一个电子
B. X原子的核外电子排布式为1s2,Y原子的核外电子排布式为1s22s2
C. X原子的2p能级上有三个电子,Y原子的3p能级上有三个电子
D. X原子核外M层上仅有两个电子,Y原子核外N层上也仅有两个电子
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 键能愈大,表示化学键越牢固,越难以断裂
B. 成键的两原子核越近,键长越短,化学键越牢固,形成的物质的性质越稳定
C. 破坏化学键时消耗能量,而形成化学键时释放能量
D. 碘易升华,这与分子中I—I键的键能大小有关
难度: 简单查看答案及解析
-
下图表示X元素的基态原子失去电子数与对应电离能的对数值的关系,试推测X可能位于
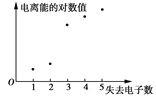
A. ⅠA族 B. ⅡA族 C. ⅢA族 D. ⅣA族
难度: 简单查看答案及解析
-
下列分子中的中心原子采取sp2杂化的是
①C6H6 ②C2H2 ③C2H4 ④C3H8 ⑤CO2 ⑥BeCl2 ⑦SO3 ⑧BF3
A. ①②⑥⑦ B. ③⑤⑦⑧ C. ①③⑦⑧ D. ③⑤⑥⑦
难度: 中等查看答案及解析
-
某物质的实验式为PtCl4·2NH3,其水溶液不导电。加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是
A.配合物中中心原子的电荷数和配位数均为6
B.该配合物可能是平面正方形结构
C. Cl﹣ 和NH3分子均与Pt4+形成配位
D.该配合物的配体只有NH3
难度: 中等查看答案及解析
-
关于原子轨道的说法正确的是
A. 凡中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体
B. CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和1个C原子的2p轨道混合起来而形成的
C. sp3杂化轨道是由同一原子中能量相近的s轨道和p轨道混合起来形成的一组能量相等的新轨道
D. 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
难度: 中等查看答案及解析
-
根据杂化轨道理论和价电子对互斥模型判断,下列分子或者离子的中心原子杂化方式及空间构型正确的是( )
选项
分子或离子
中心原子杂化方式
价电子对互斥模型
分子或离子的立体构型
A.
SO2
sp
直线形
直线形
B.
HCHO
sp2
平面三角形
三角锥形
C.
NF3
sp2
四面体形
平面三角形
D.
sp3
正四面体形
正四面体形
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列化合物的沸点相比较,前者低于后者的是
A. 乙醇与乙醚
B. 邻羟基苯甲酸(
)与对羟基苯甲
C. NH3与AsH3
D. C3F8(全氟丙烷)与C3H8
难度: 简单查看答案及解析
-
X、Y、Z是三种短周期元素,其中X、Y位于同一主族,Y、Z位于同一周期,X原子的最外层电子排布式是2s22p4,Z原子的核外电子数比Y原子少1。下列说法不正确的是
A. CX2(C是原子核内含有6个质子的原子)分子是非极性分子
B. ZH3分子的立体构型为平面三角形
C. Z4分子是非极性分子
D. H2YO4的酸性比H3ZO4强
难度: 中等查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:
① 1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是( )
A. 第一电离能:④>③>②>① B. 原子半径:④>③>②>①
C. 电负性:④>③>②>① D. 最高正化合价:④>③=②>①
难度: 中等查看答案及解析
-
表中①〜⑥为短周期元素及相应部分原子半径的数据。下列说法正确的是
元素性质
元素编号
①
②
③
④
⑤
⑥
原子半径/nm
a
0. 075
b
0.110
c
d
最高化合价
+6
+5
+5
+7
最低化合价
−2
−3
−2
−3
−1
−1
A. 元素①的最外层电子排布为2s22p4
B. 元素②氢化物与元素⑥氢化物反应形成化合物中只有共价键
C. 原子半径:a>d>b>c
D. 非金属性:元素⑤>元素④>元素①
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4∶3,Z原子比X原子的核外电子数多4。下列说法正确的是 ( )
A. W、Y、Z的电负性大小顺序一定是Z>Y>W
B. Y、Z形成的分子的空间构型可能是正四面体
C. W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z
D. WY2分子中σ键与π键的数目之比为2∶1
难度: 中等查看答案及解析