-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 用惰性电极电解CuSO4溶液一段时间后,若加入29.4 gCu(OH)2 能使溶液复原,则电解过程中转移电子的数目为1.2NA
B. 常温常压下,0.5 molO3与11.2 LO2 所含的分子数均为0.5NA
C. 一定条件下,丁烷催化裂化生成1mol乙烯时,消耗丁烷的数目为NA
D. 25℃时,1LpH=10的NaHCO3溶液中含有H2CO3的数目为10-4NA
难度: 中等查看答案及解析
-
下列对文中描述内容的相关解释正确的是( )
选项
描述
解铎
A
丹砂烧之成水银,积变又还成丹砂
两个反应互为可逆反应
B
凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之
其中“瓦”的主要成分为硅酸盐
C
硝石(KNO3)如握盐雪不冰,强烧之,紫青烟起
产生“紫青烟”的原因为KNO3分解
D
其法用浓酒精和槽入瓶,蒸令气上,用器承滴露
其中涉及的操作方法为蒸发浓缩
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列关于有机化合物的说法正确的是( )
A. 分子式为C8H8O2 的芳香族化合物中属于羧酸的同分异构体有3 种
B. 麦芽糖的水解产物有两种,且互为同分异构体
C. 等质量的苯和苯乙烯(
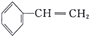 )完全燃烧,消耗氧气的体积相同
)完全燃烧,消耗氧气的体积相同D. 分子式为C4H8Cl2 且含有两个甲基的有机物有4种
难度: 中等查看答案及解析
-
用下列实验方案及所选玻璃仪器(非玻璃任选),就能实现相应实验目的的是( )
序号
实验目的
实验方案
所选玻璃仪器
A
除去KNO3中少量NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤
酒精灯、烧杯、玻璃棒
B
证明HClO与CH3COOH的酸性强弱
同温下用pH试纸测定浓度为0.1mol/L'NaClO溶液和0.1mol/LCH3COONa溶液
玻璃棒、玻璃片
C
检验蔗糖水解产物且具有还原性
向蔗糖容易中加入几滴稀硫酸,水浴加热5分钟,再向其中加入新制银氨溶液,水浴加热
试管、烧杯、酒精灯、滴管
D
配制1L1.6%的硫酸铜溶液(其密度为1.0g/mL)
将25gCuSO4·5H2O溶解在975g水中
烧杯、量筒、玻璃棒
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
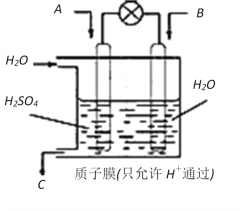
已知高能锂离子电池的总反应式为2Li+FeS
Fe+Li2S,LiPF6·SO( CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法不正确的是
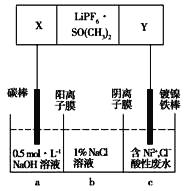
A. 电极Y应为Li
B. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
C. X极反应式为FeS+2Li++2e-
Fe+Li2S
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
难度: 中等查看答案及解析
-
X、Y、Z、W 为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。其转化关系如图所示,下列判断错误的是
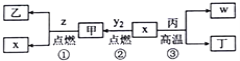
A. 反应①、②、③都属于氧化还原反应
B. X、Y、Z、W四种元素中,Y的原子半径最小
C. Na 着火时,可用甲扑灭
D. 一定条件下,x与甲反应生成丁
难度: 中等查看答案及解析
-
已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 mol•L-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的 物质的量浓度的负对数与溶液的pH的变化悄况如图所示。
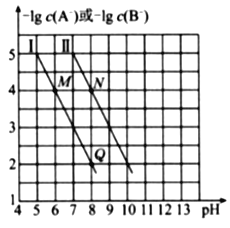
下列说法正确的是( )
A. 曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B.
C. 溶液中水的电离程度:M>N
D. N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
难度: 中等查看答案及解析
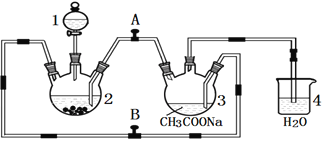
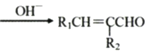 +H2O
+H2O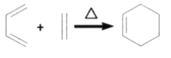
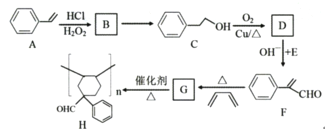
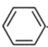 -CHO合成多环化合物
-CHO合成多环化合物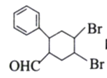 的路线(无机试剂任选)_________。
的路线(无机试剂任选)_________。