-
下列说法中不正确的是( )
A. σ键比π键重叠程度大,形成的共价键强
B. 两个原子之间形成共价键时,最多有一个σ键
C. 气体单质中,一定有σ键,可能有π键
D. N2分子中有一个σ键,两个π键
难度: 中等查看答案及解析
-
等物质的量浓度的下列五种溶液:①CH3COOH ②(NH4)2CO3 ③NaHSO4 ④NaHCO3 ⑤Ba(OH)2,溶液中水的电离程度由大到小排列正确的是( )
A. ⑤③①④② B. ⑤③①②④ C. ②④③①⑤ D. ②④①③⑤
难度: 中等查看答案及解析
-
现有三种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是( )
A. 最高正化合价:③>②>① B. 原子半径:③>②>①
C. 电负性:③>②>① D. 第一电离能:③>②>①
难度: 简单查看答案及解析
-
化合物NH3与BF3可以通过配位键形成NH3·BF3,下列说法正确的是( )
A. NH3与BF3都是三角锥形 B. NH3与BF3都是极性分子
C. NH3·BF3中各原子都达到8电子稳定结构 D. NH3·BF3中,NH3提供孤电子对,BF3提供空轨道
难度: 中等查看答案及解析
-
已知H2O2分子的空间结构可在二面角中如图所示,下列有关H2O2结构的说法正确的是( )
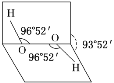
A. H2O2中有3个σ键、1个π键
B. H2O2为非极性分子
C. H2O2中氧原子为sp杂化
D. H2O2沸点高达158 ℃,可推测H2O2分子间可形成氢键
难度: 中等查看答案及解析
-
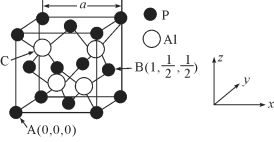
CaTiO3的晶体结构模型(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角,下列关于晶体的说法,一定正确的是( )。
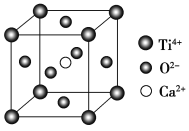
A. 分子晶体中都存在共价键
B. 如上图,CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C. SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D. 金属晶体的熔点都比分子晶体的熔点高
难度: 中等查看答案及解析
-
下列各组物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
A. ①②③ B. ④⑤⑥ C. ③④⑥ D. ①③⑤
难度: 中等查看答案及解析
-
液氨是富氢物质,是氢能的理想载体。下列说法不正确的是( )
A. NH3分子中氮原子的杂化方式为sp3杂化
B. [Cu(NH3)4]2+中,NH3分子是配体
C. NH
与PH
、CH4、BH
互为等电子体
D. 相同压强下,NH3的沸点比PH3的沸点低
难度: 中等查看答案及解析
-
氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图),已知其中一种化合物的化学式为KCuCl3,下列有关说法中错误的是( )
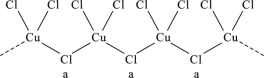
A. a位置上Cl原子的杂化轨道类型为sp3
B. 另一种的化学式为K2CuCl3
C. 铜元素在周期表中位于d区
D. 该物质中存在配位键
难度: 中等查看答案及解析
-
下列关于电解质电离的叙述中,正确的是
A. 碳酸钙在水中溶解度很小,其溶液的电阻率很大,所以碳酸钙是弱电解质
B. 碳酸钙在水中的溶解度很小,但被溶解的碳酸钙全部电离,所以碳酸钙是强电解质
C. 氯气和氨气的水溶液导电性都很好,所以它们是强电解质
D. 水难电离,纯水几乎不导电,所以水是非电解质
难度: 简单查看答案及解析
-
醋酸铅因有甜味而被称为“铅糖”,有毒但能入药,又知(CH3COO)2Pb可溶于水,硝酸铅溶液与醋酸钠溶液反应的离子方程式为:Pb2++2CH3COO-===(CH3COO)2Pb。下列有关说法不正确的是( )
A. 0.1 mol·L-1的“铅糖”溶液中c(Pb2+)<0.1 mol·L-1
B. “铅糖”是强电解质
C. “铅糖”是共价化合物
D. “铅糖”溶液的导电性可能很弱
难度: 中等查看答案及解析
-
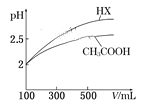
某温度下,相同pH的盐酸和醋酸溶液分别稀释, pH随溶液体积变化的曲线如上图所示。据图判断正确的是( )
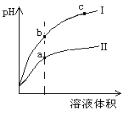
A. Ⅱ为盐酸稀释时pH变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点Kw的数值比c点Kw的数值大
D. b点酸的总浓度大于a点酸的总浓度
难度: 中等查看答案及解析
-
已知100 ℃时,0.01 mol·L-1NaHSO4溶液中水电离的c(H+)=10-10mol·L-1,该温度下将pH=8的Ba(OH)2溶液V1L与pH=5的NaHSO4溶液V2L混合,所得溶液pH=7,则V1∶V2为( )
A. 2∶9
B. 1∶9
C. 1∶1
D. 1∶2
难度: 简单查看答案及解析
-
已知:25 ℃时,HCOOH的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。下列说法正确的是( )
A. 向Na2CO3溶液中加入甲酸无明显现象产生
B. 25 ℃时,向甲酸中加入NaOH溶液,HCOOH的电离程度和K均增大
C. 向0.1 mol·L-1甲酸中加入蒸馏水,c(H+)增大
D. 向碳酸中加入NaHCO3固体,c(H+)减小
难度: 中等查看答案及解析
-
25℃时,向25mL 0.1mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是( )
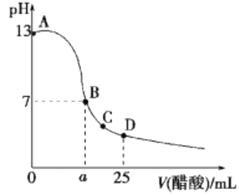
A. 在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.
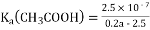
C. C点对应的溶液中,水电离出的H+浓度大于10-7mol·L-1
D. D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH) =2c(H+) -c(OH-)
难度: 中等查看答案及解析
-
常温下,0.1 mol·L-1某一元酸(HA)溶液的pH=3.下列叙述正确的是( )
A. 该溶液中:c2(H+)>c(H+)·c(A-)+Kw
B. 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
C. 浓度均为0.1 mol·L-1的HA和NaA溶液等体积混合,所得溶液中:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+)
D. 0.1 mol·L-1 HA溶液与0.05 mol·L-1 NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)=c(A-)+2c(OH-)
难度: 中等查看答案及解析