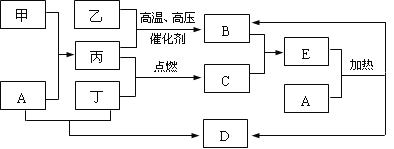
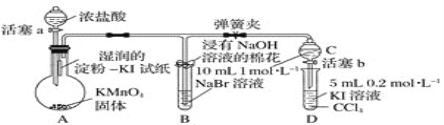
-
关于硝酸的说法正确的是( )
A. 硝酸与金属反应时,主要是+5价的氮得电子
B. 浓HNO3与浓盐酸按3∶1的体积比混合所得的混合物叫王水
C. 硝酸电离出的 H+,能被Zn、Fe等金属还 原成H2
D. 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体
难度: 中等查看答案及解析
-
下列互为同位素的一组是 ( )
A. O2、O3 B. Na2O、Na2O2 C. H2 、 D2 D. H、D、T
难度: 简单查看答案及解析
-
NH4HCO3在试管中加热,使放出的气体依次通过盛有足量过氧化钠的干燥管,足量浓H2SO4的洗气瓶,最后得到的气体是( )
A. NH3 B. O2 C. H2O D. CO2
难度: 简单查看答案及解析
-
下列关于元素周期表和元素周期律的说法正确的是
A. 整个元素周期表中,非金属元素约占五分之一
B. 第二周期元素从Li到F,原子半径逐渐增大
C. 因为Al比Na失去电子数多,所以Al比Na的还原性强
D. 整个元素周期表由7个主族、7个副族、1个0族和3个Ⅷ族组成
难度: 中等查看答案及解析
-
在元素周期表里,金属与非金属元素附近能找到( )
A. 制半导体的元素 B. 制农药的元素
C. 制催化剂的元素 D. 制耐高温合金的元素
难度: 简单查看答案及解析
-
已知①硫酸比氯酸稳定;②高氯酸是比硫酸更强的酸;③S2–比Cl–易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,与浓硫酸能反应。可说明氯比硫非金属性强的是( )
A. 只有②④ B. ②③④ C. ①②④ D. 全部
难度: 简单查看答案及解析
-
类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实验的验证.以下类推的结论正确的是 ( )
A. 由“Cl2+H2O===HCl+HClO”反应可推出“F2+H2O===HF+HFO”反应也能发生
B. HCl的水溶液是强酸,推出HF的水溶液也是强酸
C. 由“2Fe+3Cl2===2FeCl3”反应可推出“2Fe+3I2===2FeI3”反应也能发生
D. Na、K在周期表中属于同一主族,化学性质相似,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应
难度: 中等查看答案及解析
-
元素周期表中,有非金属元素的区域为( )
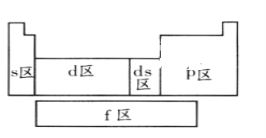
A. 只有s区 B. 只有p区 C. f区、d区和ds区 D. s区和p区
难度: 简单查看答案及解析
-
金属钛有“生物金属”之称。下列有关4822Ti和5022Ti的说法正确的是( )
A. 5022Ti原子中含有28个中子,且50是 Ti 元素的近似相对原子质量
B. 4822Ti和5022Ti在周期表中位置相同,都在第4纵行,为第IVA族
C. 4822Ti和5022Ti的物理性质相同
D. 4822Ti的质量数为48,在数值上等于该原子的近似相对原子质量
难度: 简单查看答案及解析
-
取三张蓝色石蕊试纸湿润后贴在玻璃片上,然后按顺序分别滴加浓硝酸、98.3%的浓硫酸、新制氯水,三张试纸最终变成
A.白、红、白 B.红、黑、白 C.红、红、红 D.白、黑、白
难度: 中等查看答案及解析
-
下列反应既表现硝酸的酸性,又显示硝酸的氧化性的是
A. CuO+2HNO3=Cu(NO3)2+H2O B. FeO+4HNO3=Fe(NO3)3+2H2O+NO2↑
C. C+4HNO3=CO2↑+2H2O+4NO2↑ D. NH3+HNO3=NH4NO3
难度: 简单查看答案及解析
-
原子序数大于4的主族元素Xm+、Yn-的离子核外电子层结构相同,则关于X、Y两元素的叙述正确的是
A. X的原子序数小于Y的原子序数 B. X、Y的核电荷数之差是(m-n)
C. X和Y处于同一周期 D. Y元素与X元素的族序数之差是8-(m+n)
难度: 简单查看答案及解析
-
根据原子结构及元素周期律的知识,下列推断正确的是( )
A. 同主族元素含氧酸的酸性随核电荷数的增加而减弱
B. 核外电子排布相同的微粒化学性质也相同
C. 碱金属密度随核电荷数的增加逐渐增大
D. 3517Cl与3717Cl得电子能力相同
难度: 简单查看答案及解析
-
下列有关化学用语的表示正确的是( )
A. NH4Cl的电子式:
 B. S2-的结构示意图:
B. S2-的结构示意图: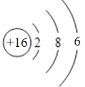
C. 氨的电子式:
D. 碳元素位于第2周期,VIA族
难度: 简单查看答案及解析
-
已知R2+离子核外有a个电子,b个中子,表示R原子符号正确的是( )
A.
R B.
R C.
R D.
R
难度: 简单查看答案及解析
-
下列有关物质结构的说法中正确的是(设NA为阿伏加德罗常数的值)( )
A. 构成单质分子的微粒一定含有共价键
B. 1.8 g NH4+中含有的电子数为NA
C. 离子化合物中一定不含有共价键
D. 离子化合物中只存在阴、阳离子之间的吸引作用
难度: 简单查看答案及解析
-
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是( )
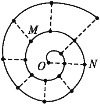
A. 离O点越远的元素原子半径越大
B. 虚线相连的元素处于同一族
C. N点代表的是图中金属性最强的元素
D. M、N点代表的元素组成的化合物中可能含有共价键
难度: 简单查看答案及解析
-
在元素周期表中前四周期的五种元素的位置关系如图所示,若五种元素的原子序数之和为85,则B元素为( )
A. Si B. P C. S D. Cl
难度: 简单查看答案及解析
-
下列化学方程式或离子方程式正确的是( )
A. 常温下,将铁片置于浓硝酸中:Fe+6HNO3=Fe(NO3)3+3NO2↑+3H2O
B. 向碳酸氢铵的稀溶液中加入少量NaOH:NH4++OH-=NH3↑+H2O
C. 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-=BaSO4↓
D. 向浓硝酸中加入铜片:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
难度: 中等查看答案及解析
-
1.92g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积可能是
A. 504mL B. 168mL C. 336mL D. 224mL
难度: 困难查看答案及解析
-
实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
A.
 氨气发生装置 B.
氨气发生装置 B. 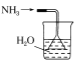 是氨气吸收装置
是氨气吸收装置C.
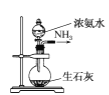 是氨气发生装置 D.
是氨气发生装置 D.  是氨气收集、检验装置
是氨气收集、检验装置难度: 中等查看答案及解析
-
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中正确的是( )
A. X、M两种元素只能形成X2M型化合物
B. Y 的气态简单氢化物的热稳定性比W 的强
C. X2M、YM2中含有相同类型的化学键
D. 元素W和M的某些单质可作为水处理中的消毒剂
难度: 简单查看答案及解析
-
将一定量的硫酸、硝酸、硝酸钾混合成100mL溶液,其中硫酸、硝酸、硝酸钾的物质的量浓度分别为6 mol/L 、2 mol/L 、1mol/L,向其中加入过量的铁粉,可产生标准状况下的混合气体(假设硝酸根离子被还原只生成NO)体积为( )
A. 4.48L B. 6.72L C. 8.96L D. 11.2L
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
L
M
X
R
T
原子半径(nm)
0.160
0.143
0.102
0.089
0.074
主要化合价
+2
+3
+6、-2
+2
-2
下列叙述正确的是( )
A. 离子半径大小:r(M3+)>r(T2-)
B. M的氧化物对应的水化物具有两性
C. X单质在氧气中燃烧生成XO3
D. L、X形成的简单离子核外电子数相等
难度: 简单查看答案及解析
-
美国FDA证实,该国地质勘测局在内华达州法隆镇的一些奶牛场附近的井水中发现了84号元素Po(钋)的一种放射性致癌同位素。钋是目前已知最稀有的元素之一,下列有关它的说法正确的是
A. 门捷列夫能预测钋在地球上的分布 B. 钋在第七周期第ⅥA族
C. 钋的最外层电子数为6 D. 钋属于副族元素
难度: 中等查看答案及解析