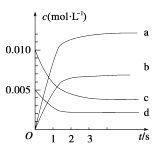
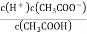-
下列有关工业生产叙述正确的是
A. 工业上通常使用电解法制备金属钠、镁、铝等
B. 合成氨工业中,将NH3及时液化分离有利于加快反应速率
C. 硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高
D. 电解精炼铜时,将粗铜与电源的负极相连
难度: 中等查看答案及解析
-
一定温度下,满足下列条件的溶液一定呈酸性的是
A. 能与金属Al反应放出H2的溶液 B. 加酚酞后显无色的溶液
C. pH=6的某溶液 D. c(H+)>c(OH—)的任意水溶液
难度: 简单查看答案及解析
-
用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中,不会引起实验误差的是
A. 用蒸馏水冼净滴定管后,装入标准盐酸进行滴定
B. 用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH溶液
C. 用甲基橙做指示剂,当溶液由黄色变成橙色,立刻读数盐酸体积
D. 用碱式滴定管取10.00 mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,加入适量蒸馏水后再进行滴定
难度: 中等查看答案及解析
-
NA为阿伏伽德罗常数的值。下列说法正确的是
A. 18g D2O和18g H2O中含有的质子数均为10NA
B. 2 L 0.5mol•L−1亚硫酸溶液中含有的H+离子数为2NA
C. 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
D. 密闭容器中,催化剂作用下2mol SO2与1mol O2充分反应,产物的分子数为2NA
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 能使甲基橙试液显红色的溶液:Na+、NH4+、Fe3+、NO3—
B. 能使苯酚变紫色的溶液:K+、Mg2+、I-、SO42-
C. 加入铝粉能产生氢气的溶液中:NH4+、K+、HCO3-、Cl-
D. 水电离产生的c(OH-)=1×10-11mol/L的溶液:Cu 2+、SO42-、NO3-、Cl-
难度: 中等查看答案及解析
-
下列事实能说明NH3·H2O一定是弱电解质的是
①常温下,NH3·H2O溶液能使酚酞变红;②用NH3·H2O溶液做导电性实验,灯泡很暗;③常温下,0.1mol / L的氨水pH约为11;④常温下,体积相同且pH相同的NH3·H2O溶液和NaOH溶液,与相同浓度的HCl溶液中和时,消耗HCl溶液的体积:前者>后者
A. ①②③④ B. ②③④ C. ③④ D. ②④
难度: 简单查看答案及解析
-
下列离子方程式中,正确的是
A. 用惰性电极电解MgCl2溶液:2Cl—+H2O通电 2OH—+Cl2↑+H2↑
B. SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO42-+2I-+4H+
C. 氯气通入冷水中:Cl2 +H2O
Cl- +ClO- +2H+
D. 碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
难度: 中等查看答案及解析
-
一种微生物燃料电池如图所示,下列关于该电池的说法正确的是
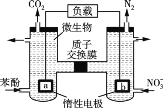
A. a电极发生还原反应
B. H+由右室通过质子交换膜进入左室
C. b电极反应式为2NO3-+10e-+12H+=N2↑+6H2O
D. 电池工作时,电流由a电极沿导线流向b电极
难度: 中等查看答案及解析
-
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
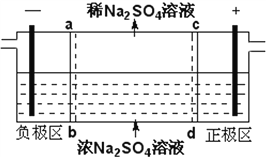
A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
难度: 中等查看答案及解析
-
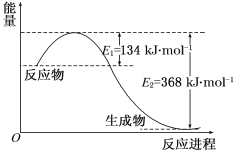
下列关于焓变(ΔH)的叙述或判断错误的是
图1
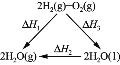 图2
图2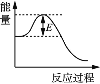
A. 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH<0
B. 500 ℃、30 MPa下,0.5 mol N2和1.5 mol H2充分反应放出 19.3 kJ 热量,则反应N2(g)+3H2(g)
2NH3(g)的ΔH=-38.6 kJ·mol-1
C. 据图1知:ΔH1=ΔH2+ΔH3
D. 据图2知:E的大小对该反应的ΔH 无影响
难度: 中等查看答案及解析
-
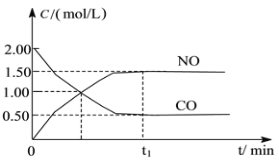
根据下列有关图象,说法正确的是:
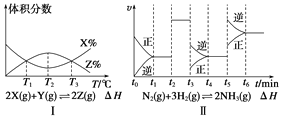
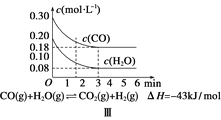
A. 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的ΔH<0
B. 由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C. 由图Ⅱ知,t3时采取增大反应体系压强的措施
D. 若图Ⅲ表示在10 L容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量
难度: 困难查看答案及解析
-
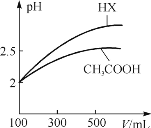
(2015•新课标1)浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随
的变化如图所示,下列叙述错误的是( )
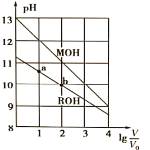
A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当
=2时,若两溶液同时升高温度,则
增大
难度: 中等查看答案及解析
 b
b