-
设阿伏加德罗常数的值为NA,下列叙述正确的是
A. 1L0.1mol·L-1Na2S溶液中含有的S2-的数目小于0.1NA
B. 同温同压下,体积均为22.4L的卤素单质中所含的原子数均为2NA
C. 1mol苯中含有的碳碳双键数为3NA
D. 78g过氧化钠固体中所含的阴、阳离子总数为4NA
难度: 中等查看答案及解析
-
铅霜(醋酸铅)是一种中药,具有解毒敛疮、坠痰镇惊之功效,其制备方法为:将醋酸放入磁皿,投入氧化铅,微温使之溶化,以三层细布趁热滤去渣滓,放冷,即得醋酸铅结晶;如需精制,可将结晶溶于同等量的沸汤,滴醋酸少许,过七层细布,清液放冷,即得纯净铅霜。制备过程中没有涉及的操作方法是
A. 萃取 B. 溶解 C. 过滤 D. 重结晶
难度: 中等查看答案及解析
-
用下列装置完成相应的实验,能达到实验目的的是
A.
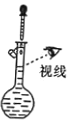 配制一定浓度的氯化钠溶液
配制一定浓度的氯化钠溶液B.
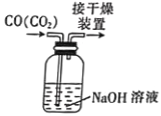 除去CO中的CO2
除去CO中的CO2C.
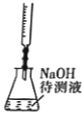 中和滴定
中和滴定D.
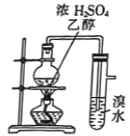 制取并检验乙烯
制取并检验乙烯难度: 中等查看答案及解析
-
傅克反应是合成芳香族化合物的一种重要方法。有机物a(-R为烃基)和苯通过傳克反应合成b的过程如下(无机小分子产物略去)
下列说法错误的是
A. 一定条件下苯与氢气反应的产物之一环己烯与螺[2.3]己烷
互为同分异构体
B. b的二氯代物超过三种
C. R为C5H11时,a的结构有3种
D. R为C4H9时,1molb加成生成C10H20至少需要3molH2
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,四种原子的最外层电子数之和为18,W与Y同主族,X原子的最外层电子数等于周期数,Z的单质在常温下为气体,下列说法正确的是
A. 原子半径:Y>X>W
B. 最简单氢化物的稳定性Z>W>Y
C. X与Z形成的化合物的水溶液能使红色石蕊试纸变蓝
D. Y的氧化物既能与碱反应,也能与酸反应・属于两性氧化物
难度: 中等查看答案及解析
-
锂亚硫酰氯(Li/SOCl2)电池是实际应用电池系列中比能量最高的一种电池,剖视图如图所示,一种非水的LiAlCl4的SOCl2溶液为电解液。亚硫酸氯既是电解质,又是正极活性物质,其中碳电极区的电极反应式为2SOCl2+4e−=4Cl−+S+SO2↑,该电池工作时,下列说法错误的是
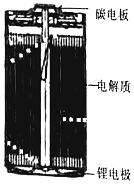
A. 锂电极区发生的电极反应:Li-e−=Li+
B. 放电时发生的总反应:4Li+2SOCl2=4LiCl+SO2↑+S
C. 锂电极上的电势比碳电极上的低
D. 若采用水溶液代替SOCl2溶液,电池总反应和效率均不变
难度: 中等查看答案及解析
-
常温下,HNO2的电离平衡常数为K=4.6×10-4(已知
2.14),向20mL0.01mol・L-1HNO2溶液中逐滴加入相同浓度的NOH溶液,测得混合液的 pH随NaOH溶液体积的变化如图所示,下列判断正确的是
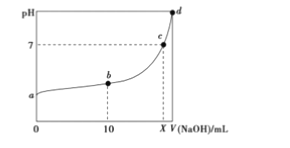
A. X=20
B. a、b、c、d四点对应的溶液中水的电离程度逐渐减小
C. a点溶液中c(H-)=2.14×10-3mol・L-1
D. b点溶液中微粒浓度的大小关系为c(HNO2)>c(Na+)>c(NO2-)
难度: 中等查看答案及解析



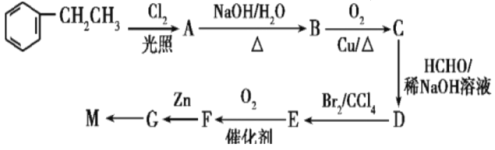
 -CH=CHCHO
-CH=CHCHO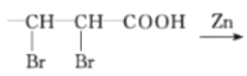 -CH=CH-COOH
-CH=CH-COOH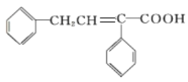 的合成路线______
的合成路线______