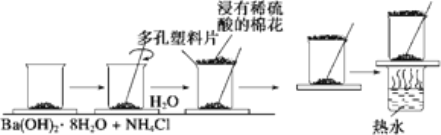
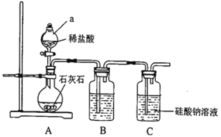
-
Y元素最高正价与最低负价的绝对值之差是 4,Y 元素与 M 元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是
A. KCl B. Na2S C. Na2O D. K2S
难度: 简单查看答案及解析
-
绿色能源是指使用不会对环境造成污染的能源,下列属于绿色能源的是
①太阳能②风能③潮汐能④煤⑤天然气⑥石油
A. ①②③ B. ③④ C. ④ D. ①②⑤
难度: 简单查看答案及解析
-
下列物质中,既含有离子键,又含有非极性共价键的是
A. Na2O2 B. H2O C. NaOH D. H2O2
难度: 中等查看答案及解析
-
低合金高强度钢是支撑"鸟巢"的铁骨钢筋,除含有铁元素外,还含有Mn(锰),Ti(钛),(铬),(铌)等合金元素,下列有关说法正确的是( )
A. Fe位于元素周期表的第四周期,第VIIIB族
B. 46TiO、 48TiO、50TiO互为同位素
C. Mn 2O7是酸性氧化物
D.
原子核内有个51个中子,核外有 41个电子
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列叙述正确的是
A. 22.4L氘(D2)气体,含有中子数为2NA
B. 1.6gNH2- 离子所含电子数为NA
C. 4g氦气所含分子数为0.5NA
D. NA个SO3分子在标准状况下的体积为22.4L
难度: 简单查看答案及解析
-
下列结论错误的是
A. 氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
B. 微粒半径:K+>Al3+>S2—>Cl—
C. 酸性:HClO4>H2SO4>H3PO4>H2SiO3
D. 金属性:K>Ca>Mg>Be
难度: 中等查看答案及解析
-
有一未完成的离子方程式: +RO
+6H+=3R+3H2O,据此判断,R元素的最高价氧化物对应的水化物的化学式为
A. H2RO3 B. H2RO4 C. HRO3 D. HRO4
难度: 中等查看答案及解析
-
下列变化中,未破坏化学键的是
A. HCl 溶于水 B. 烧碱受热熔化 C. 碘的升华 D. CaO 溶于水
难度: 简单查看答案及解析
-
等质量并且均过量的两份锌粉a和b(粉末表面积可视为相同,分别加入等体积等物质的量浓度的稀硫酸中,同时向a中加入少量硫酸铜,下图表示产生H2的体积(V)与时间(t)的关系正确的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
将盛有NH4HCO3 粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。据此下列叙述不正确的是
A. 该反应是吸热反应
B. 该反应中生成物没有反应物稳定
C. 生成物的总能量低于反应物的总能量
D. 醋酸凝固的原因是该反应吸热使大烧杯的温度降低
难度: 中等查看答案及解析
-
取一定质量的氧化亚铜和氧化铜混合粉末,将其均匀混合后分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少 6.4g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体 4.48L,则所用硝酸的物质的量浓度为
A. 3.6mol/L B. 3.2mol/L C. 2.8mol/L D. 2.4mol/L
难度: 中等查看答案及解析
-
X、Y、Z、W 是原子序数依次增大的4种短周期元素,X与Z位于同一主族,X原子的最外层电子数是次外层电子数的2倍,Y元素的单质既能与盐酸反应又能与 NaOH 溶液反应,X、Y、Z、W 原子的最外层电子数之和为18。下列说法不正确的是
A. X单质在一定条件下能与Z的最高价氧化物发生置换反应
B. 原子半径:Y>Z>W
C. 最高价氧化物对应水化物的酸性由弱到强的顺序:Z<X<W
D. W 的氧化物对应水化物一定是强酸
难度: 中等查看答案及解析
-
元素X 有质量数为 79 和 81 的两种同位素,现测得X 元素的相对原子质量为 79.9,则同位素81 X在X元素中的质量分数是
A. 45.6% B. 54.4% C. 55% D. 45%
难度: 中等查看答案及解析
-
在短周期元素中,X 元素与 Y、Z、W 三元素相邻,X、Y 的原子序数之和等于 Z 的原子序数,这四种元素原子的最外层电子数之和为 20.下列判断正确的是
A. 四种元素中,Z 的最高价氧化物对应水化物酸性最强
B. X、Y、Z、W 形成的单质最多有 6 种
C. 四种元素均可与氢元素形成 18 电子分子
D. 四种元素的原子半径:rZ>rX>rY>rW
难度: 中等查看答案及解析
-
X、Y、Z和W代表原子序数依次增大的四种短周期主族元素.它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17。下列说法错误的是
A. X、Y、Z既能形成离子化合物.又能形成共价化合物
B. Y和Z元素的原子半径大小顺序为Y>Z
C. X与Y、Z之间形成的核外电子总数为10的微粒只有YX3和X2Z
D. Z、W元素的最简单氢化物的沸点和稳定性均为H2Z>H2W
难度: 困难查看答案及解析
-
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
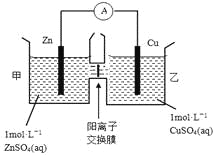
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
难度: 困难查看答案及解析