-
下列说法正确的是( )
A. 需要加热才能发生的反应一定是吸热反应
B. 吸热反应的反应物的总能量之和大于生成物的总能量之和
C. Ba(OH)2·8H2O与NH4Cl的反应是放热反应
D. 碳高温下与CO2反应是吸热反应
难度: 简单查看答案及解析
-
下列物质中含有共价键的离子化合物是( )
①MgCl2 ②Na2O2 ③NaOH ④NH4Cl ⑤CO2 ⑥H2O2 ⑦N2
A. ②③④ B. ②④⑤⑦ C. ①②③④⑥ D. ①③⑤⑥
难度: 中等查看答案及解析
-
136C-NMR(核磁共振)可以用于含碳化合物的结构分析,对于136C的碳原子说法正确的是( )
A. 核外有13个电子,其中4个能参与成键
B. 核内有6个质子,核外有7个电子
C. 质量数为13,原子序数为6,核内有7个质子
D. 质量数为13,原子序数为6,核内有7个中子
难度: 简单查看答案及解析
-
下列说法不正确的是( )
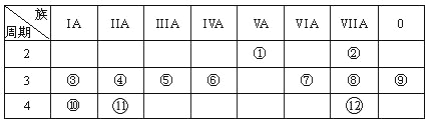
A. 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行
B. 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C. 除氦外的稀有气体原子的最外层电子数都是8
D. 同一元素的各种同位素的化学性质相似
难度: 简单查看答案及解析
-
已知R2+离子核外有10个电子,12个中子。表示R原子符号正确的是 ( )
A. 2412R B. 2210R C. 2212R D. 2010R
难度: 中等查看答案及解析
-
A、B为同主族的元素,A在B的上一周期,若A的原子序数为n,则B的原子序数不可能为( )
A. n+8 B. n+18 C. n+32 D. n+20
难度: 困难查看答案及解析
-
已知An+、B(n+1)+、Cn-、D(n+1)-具有相同的电子层结构。下列关于A、B、C、D四种元素的叙述中正确的是( )
A. 气态氢化物的稳定性:D>C
B. 原子序数:B>A>C>D
C. 最高价氧化物对应水化物的碱性:B>A
D. 四种元素一定都属于短周期元素
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 红磷、白磷属于同位素 B. H2、D2属于同素异形体
C. 4019K、4020Ca互为同位素 D. H、D、T互为同位素
难度: 中等查看答案及解析
-
下列各分子中,所有原子都满足最外层为8电子结构的是 ( )
A. BeCl2 B. CH4 C. HCl D. PCl3
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 含共价键的化合物一定是共价化合物
B. 含离子键的化合物一定是离子化合物
C. 离子化合物不可能都由非金属元素组成
D. 单质分子中一定含有共价键
难度: 困难查看答案及解析
-
表示吸热反应的图像是
A.
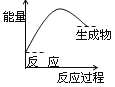 B.
B. 
C.
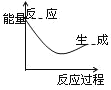 D.
D. 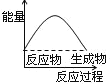
难度: 简单查看答案及解析
-
已知元素X,Y的核电荷数分别为a和b,它们的离子Xn+的Ym-的核外电子排布完全相同,则下列关系中正确的是 ( )
A. a+m=b-n B. a+b=m+n C. a-m=b+n D. a+m=b-n
难度: 困难查看答案及解析
-
对于原电池的电池名称,叙述有错误的是 ( )
A. 发生氧化反应的为负极 B. 正极为电子流入的一极
C. 比较不活泼的金属为负极 D. 电流表偏向的为正极
难度: 简单查看答案及解析
-
天然存在的Fr(钫)极微量,它的 21种同位素都有放射性,它是碱金属中最重的元素,根据它在周期表中的位置预言其性质,其中不正确的是
A. 在已知碱金属中它具有最多的电子层 B. 在空气中燃烧的时候,生成氧化物Fr2O
C. 氧化物对应的水化物是极强的碱 D. 单质的熔点不如Na的高
难度: 简单查看答案及解析
-
X元素最高氧化物对应的水化物为H2XO4,则它对应的气态氢化物为( )
A. HX B. H2X C. XH4 D. XH3
难度: 中等查看答案及解析
-
某主族元素R的最高化合价与负化合价代数和为6.下列说法正确的是()
A. R一定是第ⅦA族元素
B. R的最高价氧化物为RO3
C. R的气态氢化物能燃烧
D. R的气态氢化物易溶于水显碱性
难度: 中等查看答案及解析
-
五种短周期元素X、Y、Z、M、N,其原子半径与原子序数的关系如图,下列说法错误的是( )
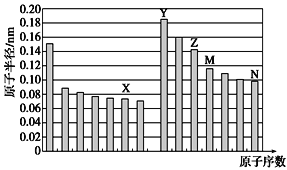
A. 非金属性:X>Z
B. 气态氢化物的稳定性:M<N
C. X和Y形成的化合物只可能含离子键
D. M最高价氧化物对应的水化物是一种弱酸
难度: 困难查看答案及解析
-
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
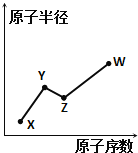
A. Y、Z、W处于同一周期
B. Y、W的最简单氢化物的水溶液能相互反应
C. X、W可形成离子化合物XW
D. X、Z、W形成的化合物均为强酸
难度: 困难查看答案及解析
-
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
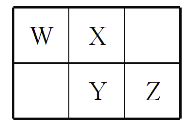
A. X、Y、Z中最简单氢化物稳定性最弱的是Y
B. Z元素氧化物对应水化物的酸性一定强于Y
C. X元素形成的单核阴离子还原性大于Y
D. Z元素单质在化学反应中只表现氧化性
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表下列叙述错误的是 ( )
元素代号
X
Y
Z
M
R
原子半径/nm
0.186
0.102
0.075
0.074
0.143
主要化合价
+1
+6-2
+5-3
-2
+3
A. 离子半径大小:Y2->M2->R3+
B. Z与M组成的化合物是形成酸雨的原因之一
C. 将YM2通入酸性高锰酸钾溶液中看不到任何现象
D. X、Y、R的最高价氧化物的水化物两两之间能发生反应
难度: 中等查看答案及解析