-
下列A、B两种元素的原子序数,其中可以组成AB2型离子化合物的是( )
A. 6和8 B. 19和16 C. 12和17 D. 10和8
难度: 简单查看答案及解析
-
a,b,c,d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族。下列叙述正确的是( )
A. 4种元素中b的金属性最强 B. 原子半径:d>c>b>a
C. c的氧化物的水化物是强碱 D. d单质的氧化性比a单质的氧化性强
难度: 中等查看答案及解析
-
“绿色化学”追求化工生产对环境零污染,下列物质中可以称为“绿色氧化剂”的是( )
A. 浓硫酸 B. 氯气 C. 双氧水 D. 漂白粉
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 碘化氢气体分解和石英熔化克服的化学键类型不同
B. MgF2晶体中存在离子键和共价键
C. Cl2、Br2、I2的分子间作用力依次增大,沸点依次升高
D. N3和NH3两种分子中,每个原子的最外层都具有8电子稳定结构
难度: 简单查看答案及解析
-
下列化学用语或模型正确的是( )
A. 氯化氢的电子式:
B. 硫离子结构示意图:
C. 8个中子的碳原子:12C: D. CH4分子的比例模型:

难度: 中等查看答案及解析
-
2H、13C、15N、18O、34S等常用作环境分析指示物,下列对它们的说法正确的是( )
A. 34S原子核内的中子数为16 B. 13C和15N原子核内的质子数相差2
C. 16O与18O互称同位素 D. 2H的核外电子数比1H多一个
难度: 中等查看答案及解析
-
下列各组顺序的排列不正确的是( )
A. 原子半径:Na>Mg>Al B. 热稳定性:HCl> H2S>PH3
C. 还原性:I–<Br–<Cl– D. 熔点:金刚石>食盐>干冰
难度: 简单查看答案及解析
-
下列各组顺序的排列不正确的是( )
A. 酸性强弱:HClO4>H2SO4>H3PO4 B. 离子半径:Na+>Mg2+>Al3+>F-
C. 热稳定性:HCl>H2S>PH3>SiH4 D. 熔点:SiO2>NaCl>I2>CO2
难度: 中等查看答案及解析
-
下列物质中,既含离子键又含共价键的是( )
A. HCl B. NaOH C. NaCl D. O2
难度: 中等查看答案及解析
-
据报道,月球上有大量3He存在,以下关于3He的说法正确的是( )
A. 是4He的同素异形体 B. 比4He多一个中子
C. 是4He的同位素 D. 比4He少一个质子
难度: 简单查看答案及解析
-
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
A. 常压下五种元素的单质中,Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的氢化物比X的氢化物稳定
D. Y元素最高价氧化物对应水化物比W元素的最高价氧化物对应水化物的酸性强
难度: 中等查看答案及解析
-
据报道,最近科学家在宇宙中发现H3分子,则H3和H2属于( )
A. 同位素 B. 同素异形体 C. 同种物质 D. 以上都不是
难度: 中等查看答案及解析
-
20世纪20年代起,就有人预言可能存在由4个氧原子构成的氧分子,但一直没有得到证实。最近,意大利一所大学的科学家使用普通氧分子和带正电的氧离子制造出了这种新型氧分子,并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,你认为该氧分子是( )
A. 氧元素的一种同位素 B. 臭氧的同分异构体
C. 一种新的氧化物 D. 可能是共价键构成的分子
难度: 中等查看答案及解析
-
干冰气化时,下列各项中发生变化的是( )
A. 分子间化学键 B. 分子间距离 C. 分子构型 D. 分子大小
难度: 中等查看答案及解析
-
下列递变规律不正确的是( )
A. Na、Mg、Al还原性依次减弱 B. I2、Br2、Cl2氧化性依次增强
C. C、N、O原子半径依次增大 D. P、S、Cl最高正价依次升高
难度: 中等查看答案及解析
-
A、B两元素可形成AB型离子化合物,如果A、B两种离子的核外电子数之和为20,则A、B两元素所处的周期为( )
A. 在同一周期 B. 一种在第一周期,一种在第二周期
C. 一种在第二周期,一种在第三周期 D. 一种在第三周期,一种在第四周期
难度: 简单查看答案及解析
-
同周期的X、Y、Z三种元素的最高价氧化物对应水化物分别是:H3XO4、H2YO4、HZO4,下列判断正确的是( )
①阴离子的还原性按X、Y、Z顺序减弱 ②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小 ④气态氢化物的稳定性按X、Y、Z顺序减弱
⑤酸性由强到弱的顺序是:HZO4
H2YO4
H3XO4
A. ①② B. ②③⑤ C. ①②③⑤ D. ①②③④
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 原子最外层电子数为2的元素一定处于周期表IIA族
B. 原子序数相差2的两元素不可能处于同一主族
C. 可根据氢化物的稳定性和酸性强弱,来判断非金属元素得电子能力强弱
D. 非金属元素的最高化合价不超过其元素电子的最外层电子数
难度: 中等查看答案及解析
-
下图形象地表示了氯化钠的形成过程,下列相关叙述中,不正确的是( )
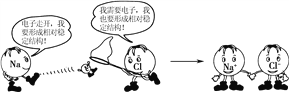
A. 钠原子易失去一个电子,氯原子易得到一个电子
B. 钠离子与钠原子有相似的化学性质
C. 钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D. 氯化钠是离子化合物
难度: 中等查看答案及解析
-
几种短周期元素的原子半径和主要化合价见下表,下列有关说法中,正确的是( )
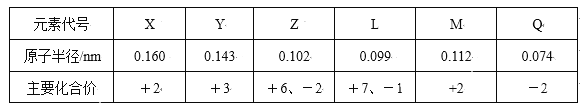
A. 等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多
B. Y与Q形成的化合物不可能跟氢氧化钠溶液反应
C. Z的氢化物的稳定性强于L的氢化物的稳定性
D. 与稀盐酸反应的剧烈程度:M单质<X单质
难度: 中等查看答案及解析
-
短周期元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列说法不正确的是( )
A. X是钠元素 B. 离子半径X+>Z2-
C. 同族元素中Z的氢化物稳定性最强 D. 同周期元素中Y的非金属性最强
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
A. X的气态氢化物比Y的稳定
B. W的最高价氧化物对应水化物的酸性比Z的强
C. Z的非金属性比Y的强
D. X与Y形成的化合物都易溶于水
难度: 中等查看答案及解析
-
已知原子序数,可以推断原子的( )
①质子数②中子数③质量数④核电荷数⑤核外电子数⑥原子结构示意图⑦元素在周期表中的位置
A. ①②③④⑥ B. ①④⑤⑥⑦ C. ②③④⑤⑦ D. ③④⑤⑥⑦
难度: 简单查看答案及解析
