-
下列溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
B. 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-)
D. 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
难度: 困难查看答案及解析
-
下列关于能源和作为能源的物质叙述错误的是( )
A. 化石能源物质内部蕴涵着大量的能量
B. 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C. 物质的化学能可以在不同的条件下转化为热能、电能被人类利用
D. 吸热反应没有利用价值
难度: 简单查看答案及解析
-
25 ℃、101 kPa时,强酸与强碱的稀溶液中发生中和反应的中和热为57.3 kJ·mol-1,则下列描述正确的是( )
A. KOH(aq)+1/2H2SO4(aq)===1/2 K2SO4(aq)+H2O(l) △H=-57.3 kJ·mol-1
B. NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) △H=+57.3 kJ·mol-1
C. H2SO4和Ca(OH)2反应的中和热为△H=2×(-57.3)kJ·mol-1
D. 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
难度: 中等查看答案及解析
-
拆开1 mol 共价键所吸收的能量或形成1 mol 共价键所释放的能量称为键能。已知:H-H键能为436 kJ /mol,H-N键能为391 kJ /mol, N2 (g)+ 3H2(g)
2NH3(g) △H=-92.4 kJ /mol,下列说法中正确的是( )
A. H-H比N≡N更牢固
B. N≡N键能约为946 kJ/mol
C. 合成氨反应选择适当的催化剂是为了提高H2的转化率
D. 0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ
难度: 中等查看答案及解析
-
已知热化学方程式: 2H2(g) + O2(g) = 2H2O(g) △H1=-483.6kJ/mol,则对于热化学方程式:2H2O(l) =2H2(g) + O2(g) △H2下列说法正确的是( )
A. 热化学方程式中化学计量系数表示分子个数
B. 该反应的△H2=+483.6kJ/mol
C. ︱△H2|<︱△H1|
D. ︱△H2|>︱△H1|
难度: 中等查看答案及解析
-
在1 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)
M(g)+N(g),所得实验数据如下表:
实验编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
700
0.10
0.10
0.09
②
800
0.20
0.20
0.10
③
800
0.20
0. 30
a
④
900
0.10
0.15
b
下列说法错误的是( )
A. 实验①中,若5 min时测得n(M) =0.05 mol,则0至5 min时间内,用N表示的平均反应速率v(N) =0.01 mol/( L·min)
B. 实验②中,该反应的平衡常数K=1.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.06
难度: 困难查看答案及解析
-
某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。
X
Y
W
n(起始状态)/mol
2
1
0
n(平衡状态)/mol
1
0.5
1.5
下列说法正确的是( )
A. 升高温度,若W的体积分数减小,则此反应ΔH>0
B. 该温度下,此反应的平衡常数K=6.75
C. 增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D. 该温度下,再向该容器中加入1.5 mol W,达到新平衡时,c(X)=0.25 mol·L-1
难度: 中等查看答案及解析
-
在容积为2 L的密闭容器中发生反应xA(g)+yB(g)
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )

A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)
zC(g)的△H<0,且a=2
难度: 中等查看答案及解析
-
有关常温下pH均为3的醋酸和硫酸的说法正确的是( )
A. 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol·L-1
B. 分别加水稀释100倍后,两种溶液的pH仍相同
C. 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等
D. 分别加入足量锌片,两种溶液生成H2的体积相同
难度: 中等查看答案及解析
-
室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将 1 mol 的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s)
CuSO4(s)+5H2O(l),热效应为△H 3。则下列判断正确的是( )
A. △H2>△H3
B. △H1<△H3
C. △H1+△H3=△H2
D. △H1+△H2>△H3
难度: 中等查看答案及解析
-
在一定温度下,反应2HBr(g)
H2(g)+Br2(g) △H>0,达到平衡时,要使混合气体颜色加深,可采取的方法是( )
A. 减小压强 B. 缩小体积 C. 降低温度 D. 增大氢气的浓度
难度: 中等查看答案及解析
-
下列有关反应速率的说法中正确的是( )
A. 氢气与氮气能够缓慢反应生成氨,使用合适催化剂可以提高反应速率
B. 等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率相等
C. 用铁片与硫酸制备氢气时,浓硫酸可以加快产生氢气的速率
D. 二氧化硫催化氧化反应的ΔH<0,所以升高温度,反应速率减小
难度: 中等查看答案及解析
-
在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B. 6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C. 反应至6 min时,c(H2O2)=0.3 mol/L
D. 反应至6 min时,H2O2分解了50%
难度: 中等查看答案及解析
-
可知某可逆反应在密闭容器中进行:A(g)+2B(g)
3C(g)+D(s) ΔH<0,右图中曲线b代表一定条件下该反应的进程。若使曲线b变为曲线a,可采取的措施是( )
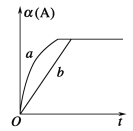
①增大A的浓度 ②缩小容器的容积
③增大B的浓度 ④升高温度
⑤加入合适的催化剂
A. ① B. ②④ C. ②⑤ D. ②③
难度: 中等查看答案及解析
-
在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)
xC(g)+2D(g)。2 min后该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol/L,下列判断错误的是( )
A. x=1
B. 2 min内A的反应速率为0.3 mol/(L·min)
C. B的转化率为40%
D. 若混合气体的密度不变,则表明该反应达到平衡状态
难度: 困难查看答案及解析
-
向FeCl3溶液中滴加2滴KSCN溶液,发生反应达到平衡Ⅰ。保持温度不变,仅改变某一个条件达到平衡Ⅱ,两次平衡时各物质的浓度如下:
Fe3+(aq)+3SCN-(aq)
Fe(SCN)3(aq)
平衡Ⅰ/(mol·L-1) a b c
平衡Ⅱ/(mol·L-1) x y z
下列叙述不正确的是( )
A. 存在关系式:c/ab3=z/xy3
B. 存在关系式:(a-x)∶(b-y)∶(z-c)=1∶3∶1
C. 向溶液中加入少量铁粉,溶液颜色变浅
D. 当溶液中c(SCN-)保持不变时达到平衡状态
难度: 中等查看答案及解析
-
已知反应X(g)+Y(g)
nZ(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( B )
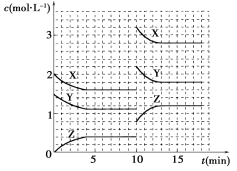
A. 反应方程式中n=1
B. 10 min时,曲线发生变化的原因是升高温度
C. 10 min时,曲线发生变化的原因是增大压强
D. 0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-1
难度: 困难查看答案及解析
-
下列说法中正确的是( )
A. 常温下,稀释0.1 mol·L-1的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降
B. pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C. 常温下,c(NH4+)相等的①(NH4)2SO4 ②(NH4)2Fe(SO4)2 ③NH4Cl ④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是②<①<④<③
D. 当溶液中存在的离子只有Cl-、OH-、NH4+、H+时,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
下列关系的表述中,正确的是 ( )
A. 0.1 mol·L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-)
B. 中和pH、体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1∶1
C. pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)不相等
D. 0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
难度: 中等查看答案及解析
-
常温下,取0.3 mol·L-1 HY溶液与0.3 mol·L-1 NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是( )
A. 混合溶液中由水电离出来的c(OH-)=1×10-9 mol·L-1
B. 混合溶液中离子浓度大小顺序为c(Y-)>c(Na+)>c(OH-)>c(H+)
C. c(OH-)-c(HY)=c(H+)=1×10-9 mol·L-1
D. c(Na+)=c(Y-)+c(HY)=0.3 mol·L-1
难度: 困难查看答案及解析