-
在反应3S+6KOH == K2SO3+ 2K2S +3H2O中,被氧化与被还原的硫原子数之比为( )
A. 1:2 B. 2:1 C. 1:1 D. 3:2
难度: 简单查看答案及解析
-
22688Ra可用于辐照治疗癌症,下列关于22688Ra说法正确的是( )
A. 核电荷数为138 B. 核外电子数为226
C. 中子数为50 D. 与22888Ra互为同位素
难度: 简单查看答案及解析
-
在盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的 ( )
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
化学与生活、生产密切相关,下列有关说法错误的是( )
A. 高纯单质硅用于制光电池 B. 酸雨是指pH<5.6的雨水
C. 二氧化硫可大量用于食品增白 D. 常温下,铁制容器可用于存贮浓硫酸
难度: 简单查看答案及解析
-
对于2Na + 2H2O=2NaOH + H2↑,下列说法正确的是( )
A. Na+的结构示意图:
B. H2的摩尔质量:2 g·mol-1
C. H2O中O的化合价:-1 D. NaOH电离方程式:NaOH=Na++O2-+H+
难度: 简单查看答案及解析
-
下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是( )
A. 敞口浓硫酸变重 B. 敞口浓盐酸变稀
C. 裸露的铝片表面失去光泽 D. 氢氧化钠的表面变潮湿
难度: 简单查看答案及解析
-
实验是化学研究的基础,关于下列各实验装置图的叙述正确的是( )
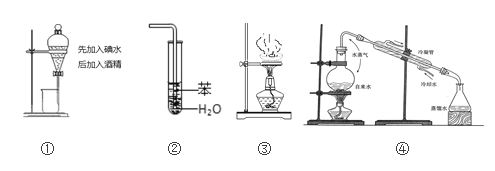
A. 装置①中溶液上层无色,下层紫红色 B. 装置②可用于吸收SO2气体,并防止倒吸
C. 装置③中液体蒸干后停止加热 D. 装置④可用于制取蒸馏水
难度: 简单查看答案及解析
-
下列有关工业生产的叙述中正确的是( )
A. 工业电解氯化钠溶液可得到金属钠
B. 工业上,利用光照氯气和氢气的混合物生产盐酸
C. 从铝土矿到铝单质过程中未涉及氧化还原反应
D. 工业接触法制硫酸的主要设备有沸腾炉、接触室、吸收塔
难度: 简单查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能一步实现的是( )
A. Fe
FeCl2
FeCl3 B. Al
NaAlO2
Al(OH)3
C. S
SO3
BaSO4 D. Na
Na2O
NaOH
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A. NaHCO3溶液中滴加硫酸:CO32- + 2H+=H2O + CO2↑
B. 铁片上滴加FeCl3溶液:Fe + Fe3+=2Fe2+
C. AlCl3溶液中加入氨水:Al3+ + 3NH3•H2O=Al(OH)3↓+ 3NH4+
D. H2S通入NaOH溶液中: H++ OH-=H2O
难度: 中等查看答案及解析
-
根据下列各反应,判断有关物质还原性由强到弱的顺序是( )
①H2SO3 + I2 + H2O = 2HI + H2SO4
②2FeCl3 + 2HI = 2FeCl2 + 2HCl + I2
③3FeCl2 + 4HNO3 = 2FeCl3 + NO↑ + 2H2O + Fe(NO3)3
A. H2SO3>HI>FeCl2>NO B. NO>FeCl2>H2SO3>HI
C. I2>FeCl2>H2SO3>NO D. FeCl2>HI>H2SO3>NO
难度: 中等查看答案及解析
-
设 NA 为阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,11.2 L SO3 中含有的分子数目为 0.5NA
B. 5.6g 铁粉与足量硫混合加热,反应转移电子数为 0.3NA
C. 常温下,1 mol氩气含有的质子数为20NA
D. 含有0.2 mol H2SO4 的浓硫酸和足量 Cu 反应能产生的气体分子数小于0.1NA
难度: 中等查看答案及解析
-
下列各组离子能大量共存的是( )
A. 0.1 mol·L-1 NaAlO2溶液中:OH-、Na+、Cl-、SO42-
B. 与Al反应放出氢气的溶液中:Na+、Ca2+、Cl-、HCO3-
C. 0.1 mol·L-1 FeCl3溶液中:Fe2+、NH4+、SCN-、SO42-
D. 强酸性溶液中:NH4+、Al3+、S2-、Cl-
难度: 中等查看答案及解析
-
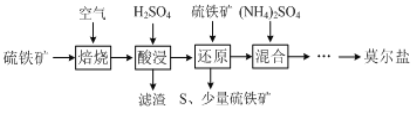
某工厂的一个生产工艺流程如图所示,下列叙述正确的是( )
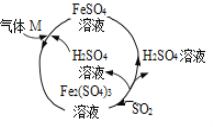
A. 该工艺流程的目的是制备 Fe2(SO4)3
B. 气体 M一定是 SO3
C. 气体 M 参加的反应是化合反应
D. SO2 参加反应时氧化剂和还原剂的物质的量之比是 1∶1
难度: 中等查看答案及解析
-
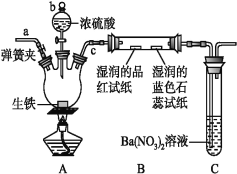
在探究SO2的性质实验中,下列根据实验现象得出的结论不正确的是( )
A. 将过量的SO2通入石蕊溶液中,溶液由紫色变为红色,说明SO2不能漂白石蕊
B. 向溴水中通入SO2,溶液褪色,说明+4价硫具有还原性
C. 向SO2水溶液中滴加Ba(NO3)2溶液,产生的白色沉淀是BaSO3
D. 向SO2水溶液中加入NaHCO3粉末,有气泡产生,说明H2SO3酸性强于H2CO3
难度: 中等查看答案及解析
-
胆矾(CuSO4•5H2O)高温时发生反应:2CuSO4•5H2O
2CuO + 2SO2↑+ O2↑+ 10H2O。下列装置能达到实验目的的是( )
A.
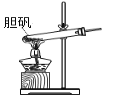 可用于胆矾分解 B.
可用于胆矾分解 B. 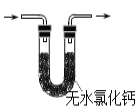 可用于检验产物是否含H2O
可用于检验产物是否含H2OC.
可用于收集SO2 D.
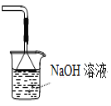 可用于吸收胆矾分解的SO2
可用于吸收胆矾分解的SO2难度: 中等查看答案及解析
-
ClO2是一种消毒杀菌剂,实验室可通过下列反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
A. KClO3在反应中得到电子 B. ClO2是氧化产物
C. H2C2O4被还原 D. 1molKClO3发生反应,转移的电子数为2NA
难度: 中等查看答案及解析
-
是一种重要的化工原料,其有关制备途径及性质如图所示下列说法正确的是

A. 相对于途径①,途径②更好地体现了绿色化学思想
B. 加Y加热过程中,Y被还原
C. CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体。
D. 将CuSO4溶液蒸干,可制得胆矾晶体
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 向含2molFeBr2的溶液中通入2molCl2:2Fe2++Cl2═2Cl-+2Fe3+
B. 向2molNaAlO2溶液中滴加5molHCl溶于水中:2AlO2- + 5H+ = Al3+ + Al(OH)3↓+ H2O
C. 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O
D. 往氢氧化钠溶液中通入少量SO2与水反应OH- + SO2 = HSO3-
难度: 困难查看答案及解析
-
一定量的锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的c(H+)=0.1 mol·L-1。下列叙述不正确的是( )
A. 反应中共消耗1.8 mol H2SO4 B. 气体甲中SO2与H2的体积比为4∶1
C. 反应中共消耗97.5 g Zn D. 反应中共转移3 mol电子
难度: 困难查看答案及解析