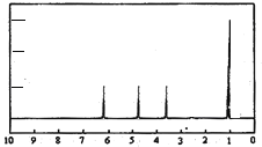
-
下列化学用语正确的是( )
A. 氘的原子结构示意图:
B. 硝基苯的结构简式:
C. 四氯化碳的比例模型:
 D. 乙炔的电子式:
D. 乙炔的电子式: 
难度: 中等查看答案及解析
-
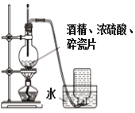
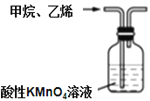
下列装置能达到实验目的的是( )
A. 制备乙烯
B. 除去甲烷中少量的乙烯
C. 从碘的苯溶液中分离碘
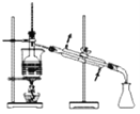
D. 验证乙炔的还原性
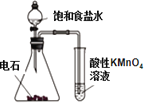
难度: 中等查看答案及解析
-
已知氟化氢气体中有平衡系:
①2H3F3(g)=3H2F2(g ) ΔH1=akJ·mol-1 ②H2F2 (g)=2HF(g) ΔH2=bkJ·mol-1 已知a、b均大于0,则可推测反应:H3F3(g)=3HF(g)的ΔH3等于( )
A. (a+b) kJ·mol-1 B. (a-b) kJ·mol-1
C. (a+3b) kJ·mol-1 D. (0.5a+1.5b) kJ·mol-1
难度: 中等查看答案及解析
-
在一个不导热的密闭反应器中,只发生两个反应:
A(g)+B(g)
2C(g) ΔH1<0;
X(g)+3Y(g)
2Z(g) ΔH2>0。
进行相关操作且达到化学平衡后(忽略体积改变所做的功),下列叙述错误的是
A. 等压时,通入惰性气体,C的物质的量不变
B. 等压时,通入Z气体,反应器中温度升高
C. 等容时,通入惰性气体,各反应速率不变
D. 等容时,通入Z气体,Y的物质的量浓度增大
难度: 困难查看答案及解析
-
某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是( )
A. 该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B. 该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C. 加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D. 加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
难度: 中等查看答案及解析
-
支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
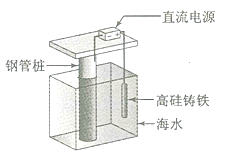
A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
难度: 中等查看答案及解析
-
二烯烃与单烯烃作用生成六元环状化合物的反应常用于有机合成,其反应形式可示例为:
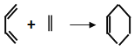
如果要用这一反应方式合成:
,则所用原料的名称是( )
A.
丁烯和
乙基
,
丁二烯 B.
丁烯和
甲基
,
丁二烯
C.
丁烯和
乙基
,
丁二烯 D. 乙烯和
甲基
,
丁二烯
难度: 中等查看答案及解析
-
关于下列各图的叙述正确的是( )
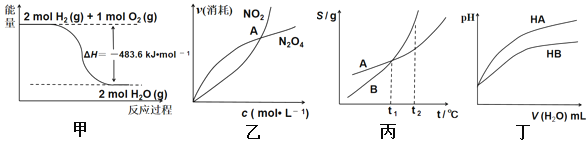
A. 甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热为△H=-483.6kJ·mol-1
B. 乙表示恒温恒容条件下发生的可逆反应2NO2 (g)
N2O4 (g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C. 丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D. 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
难度: 中等查看答案及解析
-
一定温度下,将 A、B气体各1 mol充入2L恒容密闭容器,发生反应A(g)+B(g)
xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确是( )
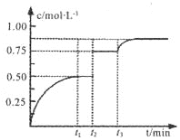
A. 反应方程式中的x=1
B. t2时刻改变的条件是使用催化剂
C. t3时刻改变的条件是移去少量物质D
D. t1~t3间该反应的平衡常数均为4
难度: 中等查看答案及解析
-
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的
为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应
:O3
O2+[O] ΔH>0 平衡常数为
;
反应
:[O]+O3
2O2 ΔH<0平衡常数为
;
总反应:2O3
3O2 ΔH<0平衡常数为K。
下列叙述正确的是( )
A. 降低温度,K减小
B.
C. 适当升温,可提高消毒效率
D. 压强增大,
减小
难度: 简单查看答案及解析
-
一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s)
CaO(s)+CO2(g),达到平衡,下列说法正确的是
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍
B.CaCO3(s)加热分解生成CaO(s)和CO2(g),△S<0
C.将体积增大为原来的2倍,再次达到平衡时,气体的密度变小
D.保持容器体积不变,充入He,平衡向逆反应方向进行
难度: 中等查看答案及解析
-
烯烃在一定条件下发生氧化反应,碳碳双键断裂,如:
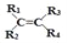 被氧化为
被氧化为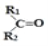 和
和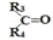
、
、
、
表示烃基或氢原子
。由此推断分子式为
的烯烃所有可能的氧化产物有( )
A. 5种 B. 6种 C. 7种 D. 8种
难度: 中等查看答案及解析
-
常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A. 1 L
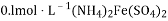 的溶液中
的溶液中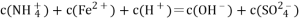
B.
溶液中:
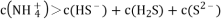
C.
为 4 的NaHA溶液中:
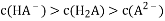
D. 等浓度的碳酸钠和碳酸氢钠混合溶液中:
难度: 中等查看答案及解析
-
工业上氟气可作为火箭燃料中的氧化剂。1886年法国化学家
通过电解氟氢化钾
的氟化氢无水溶液第一次制得氟气。已知:
,制备氟气的电解装置如下图所示。下列说法错误的是( )
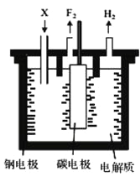
A. 钢电极与电源的负极相连
B. 氟氢化钾在氟化氢中可以电离
C. 阴极室与阳极室必须隔开
D. 电解过程需不断补充的X是KF。
难度: 中等查看答案及解析
-
常温下,在新制氯水中滴加NaOH溶液,溶液中水电离的
与NaOH溶液体积之间的关系如下图所示,下列推断正确的是( )
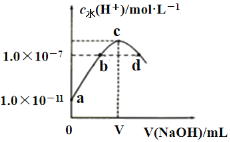
A. 用pH试纸测定a点对应溶液,其
B. b、d点对应的溶液中都存在:
C. c点对应的溶液中:

D. 常温下加水稀释d点对应的溶液,溶液的pH增大
难度: 中等查看答案及解析
-
25℃时用
溶液沉淀
、
两种金属离子
,所需
最低浓度的对数值
与
的关系如下图。下列说法中错误的是( )

A.
时,
比
的
小
B.
时,
约为
C.
溶液中:

D. 向
浓度为
的废水中加入
粉末,会有
沉淀析出
难度: 中等查看答案及解析
-
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池
电解池
A
H+移向Pb电极
H+移向Pb电极
B
每消耗3molPb
生成2molAl2O3
C
正极:PbO2+4H++2e—=Pb2++2H2O
阳极:2Al+3H2O-6e—=Al2O3+6H+
D
难度: 简单查看答案及解析
-
工业上以乙苯催化脱氢制取苯乙烯的反应如下:
(g)
。现将xmol乙苯蒸气通入体积可变的密闭容器中反应,维持体系总压强
恒定
在某催化剂作用下,乙苯的平衡转化率随温度变化如下图所示。已知:气体分压
气体总压
体积分数。不考虑副反应,下列说法正确的是( )

A.
时,向体系中通入水蒸气,
正
、
逆
均减小,且乙苯转化率降低
B.
时,向体系中通入乙苯、苯乙烯、氢气各
mol,平衡不移动
C.
时,用平衡分压代替平衡浓度表示的化学平衡常数
D.
时平衡体系中苯乙烯的体积分数是
时的3倍
难度: 困难查看答案及解析