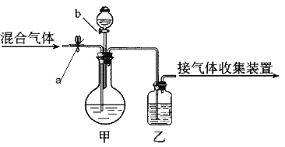
-
使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是( )
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了 ②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 ③转移溶液前容量瓶内有少量蒸馏水 ④定容时,俯视容量瓶的刻度线 ⑤定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A. ①②⑤ B. ①③⑤ C. ③④⑤ D. ②③④
难度: 中等查看答案及解析
-
30mL 1mol/L NaCl溶液和40mL 0.5mol/L CaCl2溶液混合后,混合液中Cl-浓度为:
A. 0.5mol/L B. 0.6mol/L C. 1.00mol/L D. 2mol/L
难度: 简单查看答案及解析
-
五水硫代硫酸钠(Na2S2O3·5H2O)俗称海波。医药上用作洗涤剂、消毒剂。根据化合价原理可知Na2S2O3·5H2O中S元素的化合价为
A. +6 B. +4 C. +2 D. -2
难度: 简单查看答案及解析
-
Mg和Mg2+ 相同之处是
A. 化学性质 B. 质子数 C. 核外电子数 D. 物理性质
难度: 简单查看答案及解析
-
下列微粒书写正确的是
A. 铵根离子:NH3+ B. 碳酸氢钙:CaHCO3
C. 氯化亚铁:FeCl3 D. 硫酸根离子:SO42-
难度: 简单查看答案及解析
-
下列实验基本操作中,正确的是
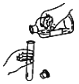
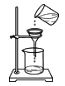
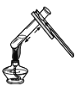

A. 倾倒液体 B. 过滤 C. 加热液体 D. 熄灭酒精灯
难度: 简单查看答案及解析
-
下列仪器:①烧杯 ②锥形瓶 ③圆底烧瓶 ④试管 ⑤坩埚,其中可用酒精灯直接加热的仪器是
A. ④⑤ B. ①②③④ C. ①③ D. ④
难度: 简单查看答案及解析
-
为了除去粗盐中的Ca2+, Mg2+,SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序
①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液
A. ④②⑤ B. ②⑤④①③ C. ④①②⑤③ D. ①④②⑤③
难度: 中等查看答案及解析
-
下列各组物质, 其分子数相同的是
A. 1 g H2和8g O2 B. 1 mol H2O和22.4L O2
C. 16g O2和3.01×1023个CO2分子 D. 9 g H2O和标准状况下11.2L乙醇
难度: 中等查看答案及解析
-
现有三组溶液:①汽油和氯化钠溶液;②苯和四氯化碳的混合溶液;③单质溴和硝酸钠的水溶液,分离以上各混合液的正确方法依次是
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 蒸馏、萃取、分液 D. 分液、蒸馏、萃取
难度: 简单查看答案及解析
-
实验中需0.5 mol/L的NaOH溶液240 ml,配制时应选用容量瓶的规格和称取NaOH的质量分别是 ( )
A、240 ml ,4.8 g B、250 ml ,5.0 g
C、500 ml ,10.0 g D、任意规格,4.8 g
难度: 简单查看答案及解析
-
将50ml 5mol/L NaOH溶液稀释到500ml,,然后取出40mL稀释后的NaOH溶液,则该溶液中NaOH的物质的量为
A. 0.25mol B. 0.02mol C. 2.5mol D. 0.2mol
难度: 简单查看答案及解析
-
1 L Na2SO4溶液中含Na+ 4.6 g, 则溶液中SO42- 浓度为
A. 0.1mol/L B. 0.4mol/L
C. 0.6mol/L D. 0.2mol/L
难度: 中等查看答案及解析
-
设NA表示阿伏德罗常数的值,下列叙述正确的是
A. 标准状况下,2.24L CH4含有的H原子数为0.1NA
B. 常温常压下,NA个CO2分子占有的体积为22.4L
C. 1 mol/L A1Cl3溶液中含有的Cl-数目为3NA
D. 标准状况下,1.7g NH3中所含的质子数为NA
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 常温下1mol CO2和NO2的混合气体中含有的原子为3NA
B. 1.8g NH4+中含有电子的数目为1.1 NA
C. 标准状况下,11.2L CO2所含有的质子数为2.2NA
D. 10.6 g碳酸钠在水中完全溶解,溶液中.Na+ 的物质的量浓度为0.1mol/L
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 把100mL3mol·L-1的H2SO4跟100mL水混合,硫酸的物质的量浓度变为1.5 mol·L-1
B. 把200mL3mol·L-1的BaCl2溶液跟100mL3mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3mol·L-1
C. 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
D. 1 L水中溶解 0.2 mol 硝酸钾,即可配得 0.2 mol/L 硝酸钾溶液
难度: 困难查看答案及解析
-
已知8.4gA物质和3.65gB物质恰好完全反应,生成标准状况下2.24L二氧化碳气体和含质子数为6.02×1023个的水分子,还有0.1mol E物质,则E物质的摩尔质量为
A. 36.5 g/mol B. 84g/mol C. 44g/mol D. 58.5g/mol
难度: 简单查看答案及解析