-
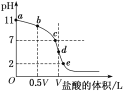
用标准盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )
A. 用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B. 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C. 用碱式滴定管取10.00 mL NaOH溶液放入蒸馏水洗净的锥形瓶中,加入少量的蒸馏水再进行滴定
D. 用酚酞作指示剂滴至红色刚变无色时即停止加盐酸
难度: 中等查看答案及解析
-
下列操作会使H2O的电离平衡向正方向移动,且所得溶液呈酸性的是( )
A. 向水中加入少量的CH3COONa B. 向水中加入少量的NaHSO4
C. 加热水至100 ℃,pH=6 D. 向水中加少量的CuSO4
难度: 简单查看答案及解析
-
化学在日常生活和生产中有着重要的应用。下列说法不正确的是( )
A. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用时,常用0.5%的Na2SO4溶液解毒
C. 含氟牙膏不能防治龋齿
D. 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用
难度: 简单查看答案及解析
-
下列事实,不能用勒夏特列原理解释的是( )
A. 热纯碱溶液比冷的纯碱溶液洗涤油污的能力强
B. 向MgCO3沉淀中滴加NaOH溶液可以得到Mg(OH)2沉淀
C. 水的离子积随温度变化如表格所示:
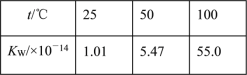
D. 对CO(g)+NO2(g)
CO2(g)+NO(g)平衡体系增大压强可使颜色变深
难度: 简单查看答案及解析
-
用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g)
2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再改变
B. 氯化氢的转化率不再改变
C. 断开4 mol H—Cl键的同时生成4 mol H—O键
D. n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
难度: 简单查看答案及解析
-
下表中物质的分类组合完全正确的是( )
编号
A.
B.
C.
D.
强电解质
Ba(OH)2
盐酸
HClO4
BaSO4
弱电解质
HI
CaCO3
HClO
NH3·H2O
非电解质
SO2
NH3
Cl2
酒精
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列有关有机物的说法不正确的是( )
A. 二氯甲烷只有1种结构说明甲烷是正四面结构
B. 乙烯分子中的所有原子共平面
C. 凡是符合通式CnH2n+2的化合物一定是烷烃
D. 凡是分子组成相差一个或若干个“CH2”原子团的物质,一定互为同系物
难度: 简单查看答案及解析
-
按系统命名法,下列烃的命名正确的是( )
A. 2—甲基—3—戊炔 B. 3—乙基—1—丁烯
C. 2,4,4—三甲基戊烷 D. 2—甲基—3—乙基己烷
难度: 简单查看答案及解析
-
既可以用来鉴别甲烷和乙烯,又可以用来除去甲烷中的少量乙烯的操作方法是( )
A. 混合气通过盛酸性KMnO4溶液的洗气瓶
B. 混合气通过盛溴水的洗气瓶
C. 混合气通过盛蒸馏水的洗气瓶
D. 混合气跟适量氯化氢混合
难度: 中等查看答案及解析
-
丁烷(化学式为C4H10)是家庭用液化石油气的成分之一,也用于打火机中作燃料,下列关于丁烷的叙述不正确的是( )
A. 在常温下,C4H10是气体
B. C4H10与CH4互为同系物
C. 丁烷有正丁烷与异丁烷两种同分异构体
D. C4H10进行一氯取代后生成两种沸点不同的产物
难度: 中等查看答案及解析
-
在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O
HS-+OH-。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大 B. 加入CuSO4固体,HS-浓度减小
C. 升高温度,c(HS-)/c(S2-)减小 D. 加入NaOH固体,溶液pH减小
难度: 简单查看答案及解析
-
下列说法中,正确的是( )
A. 难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止
B. 难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,平衡向溶解方向移动
C. Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关
D. 相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同
难度: 简单查看答案及解析
-
下列化学用语的表达正确的是( )
A. NH4++H2O=NH3·H2O+H+
B. Na2SO3+2H2O
2NaOH+2H2SO3
C. NaHCO3=Na++H++CO32-
D. BaSO4(s)
Ba2+(aq)+SO42-(aq)
难度: 简单查看答案及解析
-
下列实验操作能达到实验目的的是( )
实验目的
实验操作
A
制备Fe(OH)3胶体
将NaOH浓溶液滴加到饱和的FeCl3溶液中
B
由MgCl2溶液制备无水MgCl2
将MgCl2溶液加热蒸干
C
除去NH4Cl中混有的FeCl3
使其溶解于水,再加入氨水调节pH至7--8
D
配置FeCl3溶液
将FeCl3溶解于水
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 在0.01 mol/L Ba(OH)2溶液中:Al3+、NH4+、NO3-、HCO3-
B. pH=7的溶液中:Cl-、Fe3+、SO42-、Na+
C. 滴加KSCN溶液显红色的溶液中:NH4+、K+、Cl-、I-
D. 由水电离产生的c(H+)=1×10-13 mol/L的溶液中:Na+、Ba2+、NO3-、Cl-
难度: 简单查看答案及解析
-
t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)
2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是
物质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
2 min末浓度/mol·L-1
0.08
a
b
平衡浓度/mol·L-1
0.05
0.05
0.1
A. 平衡时,X的转化率为20%
B. t ℃时,该反应的平衡常数为40
C. 前2 min内,用Y的变化量表示的平均反应速率v(Y)="0.03" mol·L-1·min-1
D. 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动
难度: 困难查看答案及解析
-
已知:Ksp(CuS)=6.0×10-36,Ksp(ZnS)=3.0×10-25,Ksp(PbS)=9.0×10-29。在自然界中,闪锌矿(ZnS)和方铅矿(PbS)遇CuSO4溶液能转化成铜蓝(CuS)。下列有关说法不正确的是( )
A. ZnS转化成铜蓝的离子方程式为ZnS(s)+Cu2+(aq)
Zn2+(aq)+CuS(s)
B. 在水中的溶解度:S(ZnS)>S(PbS)>S(CuS)
C. 若溶液中c(Cu2+)=1×10-10 mol·L-1,则S2-已完全转化成CuS
D. 在白色ZnS浊液中滴加Pb(NO3)2溶液,不会生成黑色沉淀(PbS)
难度: 中等查看答案及解析
-
已知在100℃的温度下,水的离子积KW=1×10-12。下列说法中正确的是( )
A. 0.005 mol•L-1的硫酸溶液,pH=2
B. 0.001 mol•L-1的氢氧化钠溶液,pH=11
C. 0.005mol•L-1的硫酸溶液与0.01mol•L-1的氢氧化钠溶液等体积混合,混合溶液的pH为6,溶液显酸性
D. 完全中和pH=3的硫酸溶液50mL,需要pH=11的NaOH溶液50mL
难度: 简单查看答案及解析
-
分子式为C6H12的烃,能使溴水褪色,在催化剂作用下与氢气发生加成反应,经测定其产物中含有4个甲基,则C6H12的结构有( )
A. 1种 B. 2种 C. 3种 D. 4种
难度: 中等查看答案及解析
-
某气态烃1 mol能与2 mol HCl加成,所得的加成产物每摩尔又能与8 mol Cl2反应,最后得到一种只含C、Cl两种元素的化合物,则气态烃为( )
A. 丙烯 B. 丁烯
C. 1-丁炔 D. 2-甲基-1,3-丁二烯
难度: 简单查看答案及解析
-
下列有关溶液的说法中正确的是( )
A. 0.1 mol·L-1(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B. pH=4的醋酸稀释10倍,溶液中c(CH3COOH)、c(OH-)均减小
C. 向0.1 mol·L-1HF溶液中滴加NaOH溶液至中性,c(Na+)>c(F-)
D. pH=2的H2SO3溶液与pH=12的NaOH溶液以任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-)
难度: 中等查看答案及解析
-
不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示。下列有关说法不正确的是( )
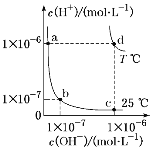
A. d点对应的食盐水pH=6,呈中性
B. 向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-)
C. a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同
D. 温度为T ℃时,0.05 mol·L-1Ba(OH)2溶液的pH=11
难度: 中等查看答案及解析