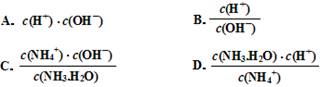-
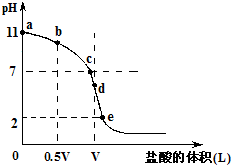
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
(1)氨水的电离方程式为______,该温度时氨水的电离平衡常数K=______.
(2)比较b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为______.
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有______.
A.c(H+)•c(OH-) B. C.
C. D.
D.
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和NH3.H2O两种形式)______.
A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3.H2O)+c(OH-)
B.点c所示溶液中:c(Cl-)=c(NH3.H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定中可能有:c(NH3.H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=______,d点之后若继续加入盐酸至图象中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为______.
-
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图像回答下列问题:
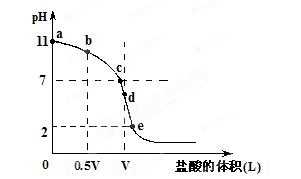
(1)氨水的电离方程式为________,该温度时氨水的电离平衡常数K=________。
(2)比较b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为________。
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有________。
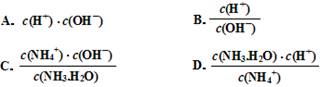
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和NH3.H2O两种形式)________。
A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3.H2O)+c(OH-)
B.点c所示溶液中:c(Cl-)=c(NH3.H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定中可能有:c(NH3.H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=________,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为________。
-
常温下,向浓度为0.1 mol·L-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
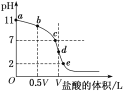
(1)该温度时NH3·H2O的电离常数K=________。
(2)滴定过程中所用盐酸的pH=________。
(3)比较b、c、d三点时的溶液中,由水电离出的c(OH-)大小顺序为___________。(填字母)
(4)滴定时,由b点到c点的过程中,下列各选项中数值变大的是___(填字母,下同)。
A.c(H+)·c(OH-) B. c(H+)·c(NH3·H2O)/c(NH4+)
C. c(NH4+)·c(OH-)/c(NH3·H2O) D. c(H+)/c(OH-)
(5)根据以上滴定曲线判断下列说法正确的是________(溶液中N元素只存在NH4+和NH3·H2O两种形式)。
A.点b所示溶液中:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(6)d点之后若继续加入盐酸至图像中的e点(不考虑NH4+水解的影响),则e点对应的横坐标为________。
-
常温下,向浓度为0.1 mol·L-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
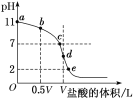
(1)该温度时NH3·H2O的电离常数K=________。
(2)滴定过程中所用盐酸的pH=________。
(3)比较b、c、d三点时的溶液中,由水电离出的c(OH-)大小顺序为____________。(填字母)
(4)在a点,将0.1 mol·L-1的NH3·H2O溶液加水稀释,下列各选项中数值变小的是________(填字母,下同)。
A.c(NH4+)/c(NH3·H2O) B.c(H+)/c(OH-)
C.c(NH4+)·c(OH-)/c(NH3·H2O) D.c(OH-)
(5)根据以上滴定曲线判断下列说法正确的是________(溶液中N元素只存在NH4+和NH3·H2O两种形式)。
A.点b所示溶液中:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.点d所示溶液中:c(H+)=c(OH-)+c(NH3·H2O)
(6) d点之后若继续加入盐酸至图像中的e点(不考虑NH4+水解的影响),则e点对应的横坐标为________。
-
常温下,向浓度为0.1 mol·L-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:

(1)该温度时NH3·H2O的电离常数K=________。
(2)滴定过程中所用盐酸的pH=________。
(3)比较b、c、d三点时的溶液中,由水电离出的c(OH-)大小顺序为___________。(填字母)
(4)滴定时,由b点到c点的过程中,下列各选项中数值变大的是___(填字母,下同)。
A.c(H+)·c(OH-) B. c(H+)·c(NH3·H2O)/c(NH4+)
C. c(NH4+)·c(OH-)/c(NH3·H2O) D. c(H+)/c(OH-)
(5)根据以上滴定曲线判断下列说法正确的是________(溶液中N元素只存在NH4+和NH3·H2O两种形式)。
A.点b所示溶液中:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(6)d点之后若继续加入盐酸至图像中的e点(不考虑NH4+水解的影响),则e点对应的横坐标为________。
-
在25℃时,向浓度为0.1mol▪L-1、体积为1.0L的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线如图所示,d点两种溶液恰好完全反应。请根据图中信息回答下列问题:
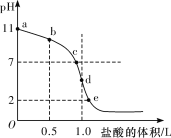
(1)在25℃时,NH3▪H2O的电离常数K=________。
(2)比较b、d两点时的溶液中,由水电离出的c(OH-)大小为b_____(填“>”“<”或“=” )d。
(3)滴定过程中所用盐酸的pH=____________。
(4)滴定时,不考虑中和滴定放热引起的温度变化,由b点到c点的过程中,下列各选项中数值会发生变化的是_________(填字母代号)。




-
常温下有浓度为0.1mol/L、体积为VL的氨水,向其中逐滴加入一定浓度的盐酸,得到如图的滴定曲线,其中d点时两种溶液恰好完全反应。根据图像回答下列问题:
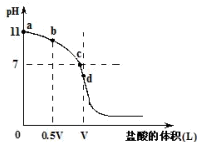
(1)上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH如下表,请将表格补充完整:
| 离子浓度大小顺序 | 溶质化学式 | 溶液的pH |
| c (NH4+)>c (OH-)>c (CI-)>c (H+) | ① | >7 |
| ② | ③ | =7 |
| ④ | NH4Cl | ⑤ |
(2)该温度时氨水的电离平衡常数K数值约为____________。滴定过程中所用盐酸的pH=____________。
(3)若取该实验中恰好完全反应的d点溶液,向其中滴加0.1VL某浓度的氨水后溶液呈中性,依(2)中计算结果计算所滴加氨水的浓度为____________ moI/L。
-
常温下,向20 mL 0.1 mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。
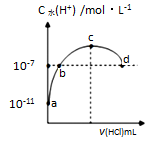
则下列说法正确的是
A. 常温下,0.1mol•L-1氨水的电离常数K约为1×10-5mol•L-1
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)=c(Cl-)
D. d点代表两溶液恰好完全反应
-
常温下,向20 mL某浓度的盐酸中逐滴加入0.1 mol/L的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述正确的是
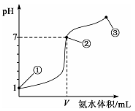
A.盐酸的物质的量浓度为l mol/L
B.在①、②之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-)
C.在点②所示溶液中:c(NH4+)=c(Cl-)>c(OH-)=c(H+),且V<20
D.在点③所示溶液中:由水电离出的c(OH-)>l0-7mol/L
-
常温下,向20 mL某浓度的盐酸中逐滴加入0.1 mol/L的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述正确的是

A.盐酸的物质的量浓度为l mol/L
B.在①、②之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-)
C.在点②所示溶液中:c(NH4+)=c(Cl-)>c(OH-)=c(H+),且V<20
D.在点③所示溶液中:由水电离出的c(OH-)>l0-7mol/L