-
中华文明源远流长,史书记载中蕴含着丰富的化学知识。下列说法不正确的是
A. 《本草纲目》记载“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”,其中“碱”指的是K2CO3
B. 《易经》记载“泽中有火……上火下泽”,其描述的是CO在湖泊池沼水面上起火的现象
C. 《本草经集注》记载“强烧之,紫青烟起,云是真硝石也”,此法是利用焰色反应鉴别“硝石”
D. 《抱朴子》记载“丹砂(HgS)烧之成水银,积变又还成丹砂”,该过程为氧化还原反应
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 4.6gC2H5OH与6.0gCH3COOH反应,生成的 CH3COOC2H3分子数目为0.1NA
B. 5.6gFe与足量水蒸气完全反应,转移的电子数目为0.2NA
C. 32gO2和O3的混合物中含有的氧原子数目为2NA
D. 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA
难度: 中等查看答案及解析
-
1,2﹣环氧丁烷如图,通常为无色液体,用于制造泡沫塑料、合成橡胶、非离子型表面活性剂等。下列关于1,2﹣环氧丁烷的说法不正确的是( )
A. 化学式为C4H8O
B. 氧原子与所有碳原子可能处于同一平面
C. 能发生氧化反应和取代反应
D. 二溴代物的结构有9种(不考虑立体异构)
难度: 中等查看答案及解析
-
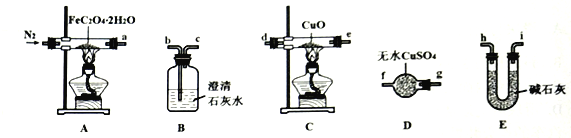
实验室模拟工业上侯德榜制碱原理制备纯碱,下列操作未涉及的是
A.
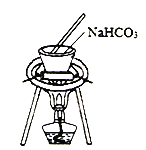 B.
B. 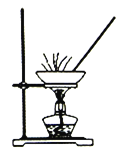 C.
C. 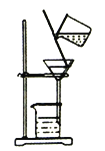 D.
D. 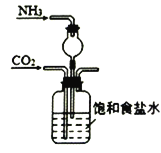
难度: 中等查看答案及解析
-
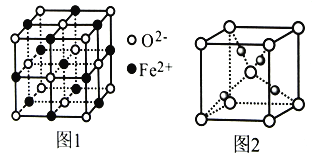
短周期主族元素W、X、Y、Z的原子序数依次增大。W的某种核素不含中子;X、Y原子核外L层的电子数之比为3︰4;X与Z同主族,且X、Y、Z原子的最外层电子数之和为16。下列说法不正确的是
A. W、X、Z三种元素形成的化合物一定为强电解质
B. 简单氢化物的稳定性:X>Z>Y
C. X与Y形成晶体的基本结构单元为四面体
D. 原子半径:Y>Z>X>W
难度: 中等查看答案及解析
-
新型镁-锂双离子二次电池如图,下列关于该电池的说法不正确的是
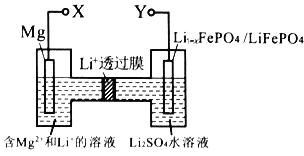
A. 放电时,Li+由左向右移动
B. 放电时,正极的电极反应式为Li1-xFePO4+xLi++xe-= LiFePO4
C. 充电时,外加电源的正极与Y相连
D. 充电时,导线上每通过1mol e-,左室溶液质量减轻12g
难度: 中等查看答案及解析
-
常温下,分别向NaA溶液和MCl溶液中加入盐酸和NaOH溶液,混合溶液的pH与离子浓度变化关系如下图所示。下列说法不正确的是
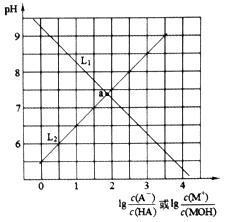
A. 曲线L1表示
与pH的变化关系
B. Ka(HA)=1×10-5.5
C. a点时两溶液中水的电离程度相同
D. 0.01mol·L-1MA溶液中存在:c(M+)>c(A-)>c(OH-)>c(H+)
难度: 困难查看答案及解析