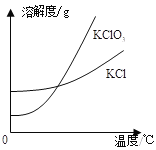
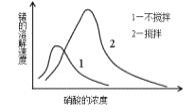
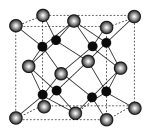
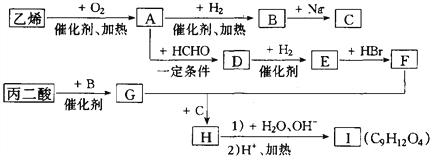
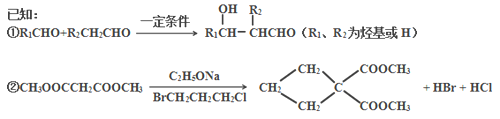
-
下列有关化学及人类社会发展历程的说法中,不正确的是
A. 道尔顿的“原子论”和阿伏加德罗的“分子学说”对化学的发展起到了极大的推动作用
B. 门捷列夫将元素按原子序数由小到大的顺序依次排列,制出了第一张元素周期表
C. 人类历史上,重金属的发现和应用较早,而轻金属的发现和应用则较晚
D. 化石燃料的使用,极大地促进了生产力的发展,但同时又伴生着能源危机和环境问题
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列有关说法正确的是
A. 常温常压下,1.8g甲基(—CD3)中含有的中子数为NA
B. 标准状况下,11.2L乙烯和环丙烷(C3H6)的混合气体中,共用电子对的数目为3NA
C. 过量铜与含0.4 mol HNO3的浓硝酸反应,电子转移数大于0.2NA
D. 常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9 NA
难度: 困难查看答案及解析
-
四个课外活动小组为完成实验目的,均设计了两套实验装置(部分图中的夹持装置略去),其中一个活动小组设计的两套装置中,有一套装置存在原理错误,该活动小组是
A.
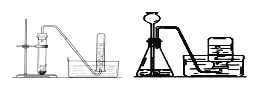
锌粒和稀硫酸制取氢气
B.
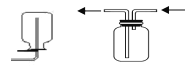
向下排空气法收集甲烷
C.
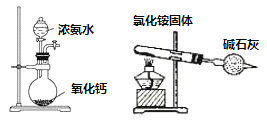
制取氨气的发生装置
D.
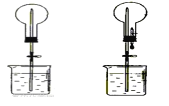
氯化氢气体的喷泉实验
难度: 中等查看答案及解析
-
位于不同主族的四种短周期元素甲、乙、丙、丁,其原子序数依次增大,原子半径r(丁) > r(乙) > r(丙) > r(甲)。四种元素中,只有一种为金属元素,乙和丙原子的最外层电子数之和为丁原子的最外层电子数的3倍。据此推断,下述正确的是
A. 丙的简单氢化物分子内存在氢键
B. 由甲、乙两元素组成的化合物中,只含有极性键
C. 由甲和丙两元素组成的分子不止一种
D. 乙和丁两元素的最高价氧化物的水化物之间能发生反应
难度: 困难查看答案及解析
-
网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构(如图)。在辛酸的同分异构体中, 含有一个“-COOH”和三个“-CH3”的结构(不考虑立体异构),除
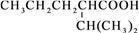 外,还有( )
外,还有( )
A. 7种 B. 11种 C. 14种 D. 17种
难度: 困难查看答案及解析
-
常温下,下列溶液中的微粒浓度关系不正确的是
A. pH=8.3的某酸式盐NaHB的水溶液中:c (Na+) > c (HB-) > c (H2B) > c (B2-)
B. 等物质的量浓度的Na2S和NaHS溶液中:c (Na+)=2c (S2-) + c (HS-)
C. NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c (Na+) > c (SO42-) > c (NH4+) > c (OH-)=c (H+)
D. 0.1 mol / L NaH2PO4溶液中:c (Na+)=c (PO43-) + c (HPO42-) + c (H2PO4-) + c (H3PO4)
难度: 困难查看答案及解析
-
为测定某草酸晶体(H2C2O4•2H2O)样品的纯度,现称取一定质量的该样品,配制成100 mL溶液,取25.00 mL该溶液于锥形瓶中,加适量稀硫酸,用0.100 mol/L的KMnO4溶液滴定(杂质不参与反应)。为省去计算过程,当称取的样品的质量为某数值时,滴定所用KMnO4溶液的毫升数恰好等于样品中草酸晶体的质量分数的100倍。则应称取样品的质量为
A. 2.25 g B. 3.15 g C. 9.00 g D. 12.6 g
难度: 中等查看答案及解析