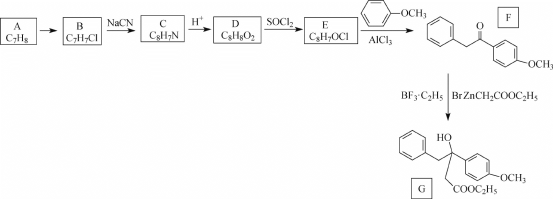
-
从废铅蓄电池铅膏(含PbSO4、PbO2和Pb等)中回收铅的一种工艺流程如下:

已知:浓硫酸不与PbO2反应,Ksp(PbCl2)=2.0×10-5,Ksp(PbSO4)=1.5×10-8,PbCl2(s)+2Cl-(aq)=PbCl42-(aq)。下列说法错误的是
A. 合理处理废铅蓄电池有利于资源再利用和防止重金属污染
B. 步骤①中可用浓硫酸代替浓盐酸
C. 步骤①、②、③中均涉及过滤操作
D. PbSO4(s)+2Cl-(aq)
PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
难度: 困难查看答案及解析
-
化学与生活密切相关。下列说法错误的是
A. 用四氯乙烯干洗剂除去衣服上油污,发生的是物理变化
B. “碳九”(石油炼制中获取的九个碳原子的芳烃)均属于苯的同系物
C. 维生素C是NaNO2中毒的急救药之一,利用了维生素C的还原性
D. 波尔多液(硫酸铜、石灰和水配成)用作农药,利用Cu2+使病毒蛋白变性
难度: 困难查看答案及解析
-
对实验室制得的粗溴苯[含溴苯(不溶于水,易溶于有机溶剂,沸点156.2℃)、Br2和苯(沸点80℃)]进行纯化,未涉及的装置是
A.
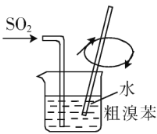 B.
B. 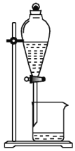
C.
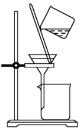 D.
D. 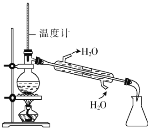
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A. 2g氘化锂(6LiD)中含中子数为NA
B. 22.4L(标准状况)CHCl3含C—H键数目为NA
C. 2molSO2和1mol18O2充分反应,产物中含18O原子数为2NA
D. 0.5molCl2通入FeCl2溶液中,最后溶液中含Fe3+数目为NA
难度: 中等查看答案及解析
-
C2H4及C2H2等均可用适当的羧酸盐采用Kolbe电解法得到。如图为制取C2H2的电解装置,该装置工作时,下列说法中错误的是

A. 电能转变为化学能
B. 阴极周围溶液的pH不断升高
C. 电极a上发生:

D. 制取乙烯可用CH3COOK溶液作阳极电解液
难度: 困难查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的最低负价等于X、Z的最低负价之和,Y的周期数是族序数的3倍,W的简单氢化物与X的简单氢化物化合形成的盐中既含离子键又含共价键。下列说法正确的是
A. 常压下,单质的沸点:W>Z
B. Y与X形成化合物的水溶液呈碱性
C. 原子半径:W<X<Y<Z
D. W的氧化物的水化物的酸性比Z的弱
难度: 中等查看答案及解析
-
25℃时,改变0.1mol·L-1H2SO3溶液的pH,各微粒的物质的量分数(α)变化如图所示,下列说法中错误的是
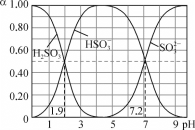
A. 1gK1(H2SO3)=-1.9
B. pH=3时,c(HSO3-)>c(H2SO3)>c(SO32-)
C. 反应H2SO3+SO32-
2HSO3-的lgK=5.3
D. pH=7.2时,c(HSO3-)=c(SO32-)=c(H+)
难度: 中等查看答案及解析
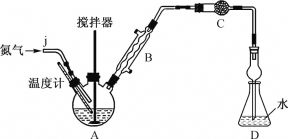
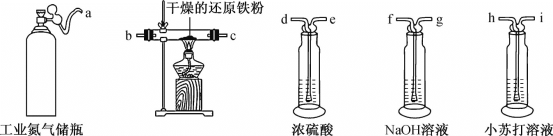
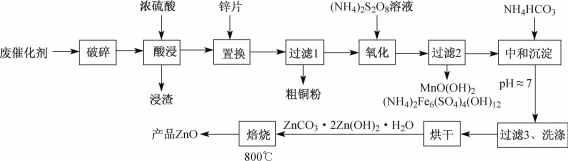

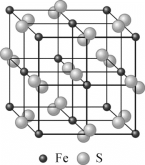
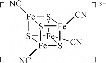 中,S、C、N的化合价依次为-2、+2、-3,Fe2+与Fe3+数目之比为________;与铁形成配位键的原子是________。
中,S、C、N的化合价依次为-2、+2、-3,Fe2+与Fe3+数目之比为________;与铁形成配位键的原子是________。