-
地壳中含量较大的三种元素是:
A. H、O、Si B. O、Si、Al C. Al、C、O D. H、O、Al
难度: 简单查看答案及解析
-
对于同一原子的下列电子层中,能量最低的是
A. K层 B. L层 C. M层 D. N层
难度: 简单查看答案及解析
-
下列离子的电子排布与Ne原子核外电子排布不同的是:
A. Mg2+ B. O2- C. Na+ D. C1-
难度: 简单查看答案及解析
-
“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的固体化学物质和水混合后摇动即会制冷或对饮料起到冷却作用。该化学物质可能是:
A. NaCl B. NH4NO3 C. CaO D. NaOH
难度: 简单查看答案及解析
-
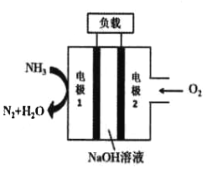
下列装置能够组成原电池的是:
A.
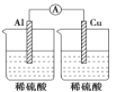 B.
B. 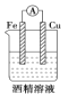 C.
C. 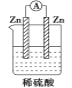 D.
D. 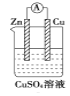
难度: 简单查看答案及解析
-
下列说法正确的是:
A. 只含一种元素的物质不一定是纯净物 B. 由相同元素形成的不同物质称同素异形体
C. 分子式为C2H6O的物质一定是乙醇 D. C5H12只有2种同分异构体,其熔点各不相同
难度: 中等查看答案及解析
-
在N2+3H2
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6 mol·L-1。在此段时间内用H2表示的平均反应速率为0.45 mol·L-1·s-1,则反应所经过的时间是( )
A.0.44 s B.1 s C.1.33 s D.2 s
难度: 简单查看答案及解析
-
以下属于放热反应的是:
①煅烧石灰石制生石灰 ②浓硫酸溶于水 ③将氢氧化钡晶体与氯化铵晶体混合后用玻璃棒搅拌使之反应 ④食物因氧化而腐败 ⑤镁与盐酸反应制氢气 ⑥盐酸与氢氧化钠的中和反应
A. ④⑤⑥ B. ①④⑤ C. ②⑤⑥ D. ②③④
难度: 简单查看答案及解析
-
下列表示正确的是:
A. CO2的电子式:
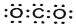 B. 乙醇的结构式:C2H5OH
B. 乙醇的结构式:C2H5OHC. 乙炔的比例模型:
 D. 氟离子的结构示意图:
D. 氟离子的结构示意图:难度: 简单查看答案及解析
-
现有下列各种物质,其中含共价键的单质是:
A. H2O B. 氦气 C. 氢气 D. 金属钠
难度: 简单查看答案及解析
-
已知氢化锂(LiH)属于离子化合物,跟水反应可放出H2。下列叙述中正确的是:
A. LiH跟水反应后得中性溶液 B. LiH中氢离子可以被还原成氢气
C. LiH中氢离子半径比锂离子半径小 D. LiH在化学反应中是一种强还原剂
难度: 中等查看答案及解析
-
离子化合物的熔点与离子的半径、离子所带的电荷有关,离子的半径越小,离子所带的电荷越高,则离子化合物的熔点就越高。试判断KCl、CaO两种晶体熔点的高低顺序:
A. KCl>CaO B. NaCl=CaO C. CaO>KCl D. 无法比较
难度: 简单查看答案及解析
-
与Ne核外电子排布相同的离子跟Ar核外电子排布相同的离子所形成的化合物是:
A. Na2O B. CCl4 C. KCl D. KF
难度: 简单查看答案及解析
-
下列各物质的晶体中,晶体类型不相同的是:
A. CO2和SiO2 B. H2O和HCl C. CO2和CCl4 D. K2SO4和MgCl2
难度: 简单查看答案及解析
-
下列各种说法中,正确的是:
A. O2与O3互为同素异形体,但两者之间的转化属于物理变化
B. 设NA为阿伏加德罗常数的值,则6.2g 白磷(P4)含有0.3NA P-P键
C. 足球烯与金刚石互为同分异构体,但二者形成的晶体类型不同
D. 12C与14C的质子数和电子数都为6,故二者是碳元素的同一种核素
难度: 中等查看答案及解析
-
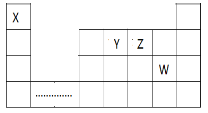
如表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法不正确的是:
X
Y
Z
W
T
A. X、W、Z元素的原子半径依次递增
B. Y元素在自然界中不能以游离态存在
C. T元素的非金属性比W弱,但比Z强
D. YX2晶体和WX3晶体的类型不同,但均存在共价键
难度: 中等查看答案及解析
-
反应:C(s)+H2O(g)
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是:
A. 增加H2O (g) 的量 B. 保持体积不变,充入氦气使体系压强增大
C. 将容器的体积缩小一半 D. 保持压强不变,充入氦气使容器容积变大
难度: 中等查看答案及解析
-
根据图的能量图,下列说法正确的是:

A. A2(g) + B2(g) = 2AB(g) 是一个放热反应
B. 2molAB的总能量大于1molA2和lmolB2的能量之和
C. 2AB(g) = A2(l) + B2(l) △H<(b-a)kJ/mo1
D. 1molA2(g)和1molB2(g)的能量之和为akJ
难度: 中等查看答案及解析
-
在恒温恒容容器中:2NO2
2NO+O2。不能说明反应达平衡状态的是:
①单位时间内生成n mol O2的同时生成2n mol NO2; ②单位时间内生成n mol O2 的同时,生成2n mol NO; ③NO2、NO、O2 的反应速率的比为2 : 2 : 1的状态; ④混合气体的颜色不再改变的状态; ⑤混合气体的密度不再改变的状态; ⑥混合气体的平均相对分子质量不再改变的状态。
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
难度: 中等查看答案及解析
-
在4 L密闭容器中进行可逆反应:X(g)+2Y(g)
2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如图。则图中阴影部分的面积表示:
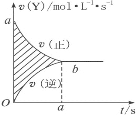
A. X的物质的量浓度的减少 B. Y的物质的量的减少
C. Z的物质的量浓度的增加 D. X的物质的量的减少
难度: 中等查看答案及解析
-
LED(Light Emitting Diode)即发光二极管,是一种能够将电能转化为光能的固态半导体器件。如图是某课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是:

A. 装置中存在“化学能→电能→光能”的转化
B. 铜片上发生的反应为2H++2e-=H2↑
C. 如果将稀硫酸换成柠檬汁,则导线中不会有电子流动
D. 如果将锌片换成铁片,则电路中的电流方向不变
难度: 中等查看答案及解析
-
在恒温恒容的密闭容器中通入lmol X和2molY,发生如下反应:X(g) + 2Y(g)
M(g) + 2N(g) △H=akJ/mol (a>0),下列说法中正确的是:
A. v正(M)=2v逆(N)时,反应到达平衡状态
B. 到达平衡状态时,反应吸收akJ能量
C. 2s 末反应达到平衡时,加入催化剂,反应速率不会发生改变
D. 2s 末反应达到平衡时,Y的消耗量是X的生成量的2倍
难度: 中等查看答案及解析
-
下列说法正确的是:
A. HCl、HBr、HI的熔点依次增大,它们分子间作用力也依次增大
B. NH3分子中,每个原子的最外层都具有8电子稳定结构
C. Na2SO4晶体属于离子晶体,该晶体中只含有离子键
D. 金刚石加热融化时需要克服分子间作用力
难度: 中等查看答案及解析
-
单斜硫和正交硫转化为二氧化硫的能量变化图如下图,下列说法正确的是:
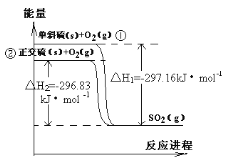
A. 单斜硫没有正交硫稳定
B. S(s,单斜)=S(s,正交) △H=+0.33 kJ· mol-1
C. 相同物质的量的正交硫比单斜硫所含有的能量高
D. ①式表示断裂l mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量少297.16 kJ
难度: 中等查看答案及解析
-
银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
2Ag+Zn(OH)2
 Ag2O+Zn+H2O在此电池放电时,负极上发生反应的物质是
Ag2O+Zn+H2O在此电池放电时,负极上发生反应的物质是A. Ag B. Zn(OH)2 C. Ag2O D. Zn
难度: 困难查看答案及解析
-
3A(g)+2B(s)
2C(g)+3D(g) △H=+a kJ·mol-1。达到平衡时,下列说法一定正确的是:
A. 当B(s)的质量不再发生变化时,说明该反应已达到平衡状态
B. 若开始时加入3 mol A和2 mol B,则反应达到平衡时共吸收a kJ热量
C. 若保持恒温、恒容不变,从反应开始到平衡的过程中,气体压强始终不变
D. 当用B表示的正反应速率等于用C表示的逆反应速率时,反应已达到平衡状态
难度: 中等查看答案及解析