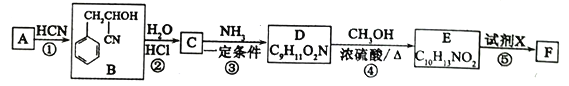-
下列有关物质的性质与用途说法正确的是
A. 胶体的胶粒带电,利用这一性质可进行“血液透析”和“静电除尘”
B. CaO能与SO2反应,可作工业废气脱硫剂
C. NaHCO3能与碱反应,因此食品工业上可用作焙制糕点的膨松剂
D. SO2和湿润的O3都有漂白性,混合后得到漂白性更强的漂白剂
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关说法正确的是
A. 0.2L 3mol·L-1的NH4Cl溶液与0.3L2mol·L-1的NH4Cl溶液中NH4+的数目均为0.6NA
B. 标准状况下,11.2L乙烯和环丙烷的混合气体中,共用电子对的数目为3NA
C. 常温下,1LpH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
D. ag某气体所含分子数为b个,则cg该气体的体积为
难度: 简单查看答案及解析
-
以物质a为原料,制备物质d(金刚烷)的合成路线如下图所示

关于以上有机物说法中错误的是
A. 物质a最多有10个原子共平面
B. 物质d的二氯代物有6种
C. 物质c与物质d互为同分异构体
D. 物质b的分子式为C10H12
难度: 中等查看答案及解析
-
聚合硫酸铁(PFS)是水处理中重要的絮凝剂,以废铁屑为原料制备PFS的具体工艺流程如下:
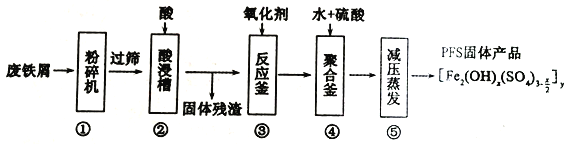
下列说法错误的是
A. 步骤①,粉碎的目的是为了增大反应物接触面积,提高“酸浸”反应速率
B. 步骤④,加稀硫酸调节pH在一定的范围内,让Fe3+部分水解形成碱式盐
C. 步骤⑤,减压蒸发,有利于降低水的沸点防止产物分解
D. 步骤③,可以选择双氧水、氯气等氧化剂将Fe2+转化成Fe3+
难度: 中等查看答案及解析
-
X、Y、Z、W为短周期元素,X的M电子层有1个电子,Y的最外层电子数为内层电子数的2倍,Z的最高化合价为最低化合价绝对值的3倍,Z与W同周期,W的原子半径小于Z。下列有关说法正确的是
A. 原子半径:X<Y<Z<W
B. Y、Z、W均可与Mg形成离子化合物
C. 气态氢化物的稳定性:Y>Z>W
D. 最高价氧化物对应水化物的酸性:Y>Z
难度: 中等查看答案及解析
-
全钒液流电池充电时间短,续航能力强,被誉为“完美电池”,工作原理如图1所示,反应的离子方程式为:VO2++V3++H2O
VO2++V2++2H+。以此电池电解Na2SO3溶液(电极材料为石墨),可再生NaOH,同时得到H2SO4,其原理如图2所示。下列说法正确的是
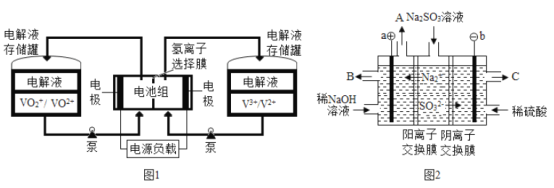
A. 电解Na2SO3溶液时,a极与电池负极相连,图1中H+从电池右边移向左边
B. 电解时b的电极反应式为SO32-+H2O-2e-=SO42-+2H+
C. 电池放电时,负极的电极反应式为VO2++e-+2H+=VO2++H2O
D. 若电解过程中图2所有液体进出口密闭,则消耗12.6gNa2SO3阴极区变化的质量为4.6g
难度: 中等查看答案及解析
-
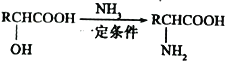
图(1)和图(2)分别为二元酸H2A和乙二胺(H2NCH2CH2NH2)溶液中各微粒的百分含量δ(即物质的量百分数)随溶液pH的变化曲线(25℃)。下列有关说法正确的是
已知:H2NCH2CH2NH2+H2O
[H3NCH2CH2NH2]++OH-
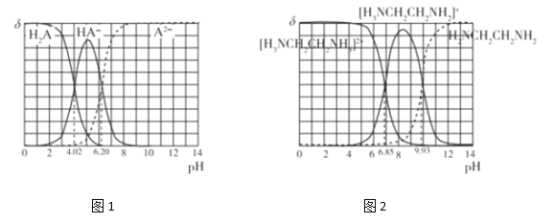
A. [H3NCH2CH2NH3]A溶液显碱性
B. NaHA溶液中各离子浓度大小关系为:c(Na+)>c(HA-)>c(OH-)>c(A2-)>(H+)
C. 乙二胺(H2NCH2CH2NH2)的Kb2=10-7.15
D. 向[H3NCH2CH2NH2][HA]溶液中通入一定量的HCl气体,则c(H2NCH2CH2NH2)c(H2A)/[c([H2NCH2CH2NH3]+)c(HA-)]可能增大也可能减小
难度: 困难查看答案及解析
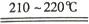 NaN3+H2O。
NaN3+H2O。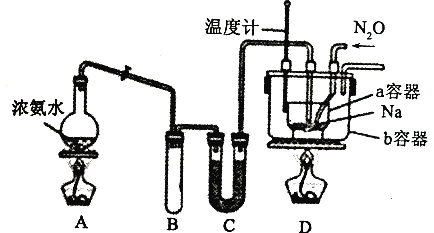



 )是一种应用广泛可食用的甜味剂,俗称蛋白糖,它的一种合成路线如图所示
)是一种应用广泛可食用的甜味剂,俗称蛋白糖,它的一种合成路线如图所示