-
下列说法不正确的是
A. 煤的脱硫、汽车尾气实行国Ⅵ标准排放都是为了提高空气质量
B. 纳米级的铁粉能通过吸附作用除去水体中的Cu2+、Hg2+等有害离子
C. 《千里江山图》中含有很多着色的矿石颜料,其中孔雀石的主要成分是碱式碳酸铜
D. Ba2+摄入过多对人体有害,但BaSO4可作为造影剂用于X—射线检查肠胃道疾病
难度: 中等查看答案及解析
-
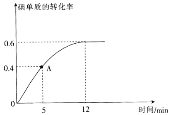
硫酸钡是一种比碳酸钡更难溶的物质。常温下-lgc(Ba2+)随-lgc(CO32-)或-lgc(SO42-)的变化趋势如图,下列说法正确的是
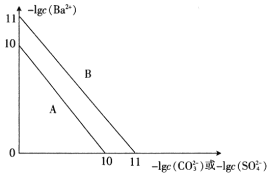
A. 趋势线A表示硫酸钡
B. 常温下,Ksp(BaCO3)=1×10-11
C. 将碳酸钡和硫酸钡固体置于水中,此时溶液中的
=10
D. 在硫酸钡悬浊液中,若要使0.1mol的硫酸钡完全转化成碳酸钡,则需要加入碳酸钠的物质的量至少为0.1mol
难度: 中等查看答案及解析
-
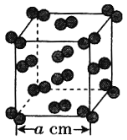
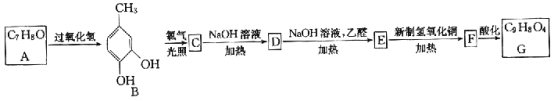
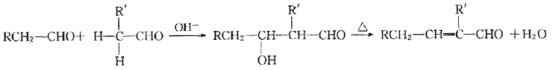
下列有关有机物的说法正确的是
A. 植物油难溶于水,可以用来萃取碘水中的I2
B. 通过煤的干馏可将煤中的甲苯、苯等有机物进行分离
C. 有机玻璃
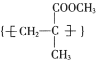 的链节是
的链节是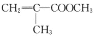
D.
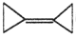 中所有的碳原子共平面
中所有的碳原子共平面难度: 中等查看答案及解析
-
X、Y、Z、W、Q是原子序数逐渐增大的短周期主族元素,其中Z、W为金属元素,Q是同一周期中非金属性最强的元素,且过量的XY2能与由Y、Z、W三种元素组成的一种化合物的水溶液反应得到一种白色沉淀,该白色沉淀能溶于过量的NaOH溶液,但不溶于氨水。下列说法正确的是
A. 原子半径:Q>Z>W
B. 熔融WQ3固体时需要破坏离子键
C. Z、W、Q三种元素的最高价氧化物对应的水化物两两之间能相互反应
D. 非金属性:Y<Q
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 常温下,含有1molCl-的NH4Cl溶液中的NH4+数目小于NA
B. 物质的量之和为1mol的16O2和18O2中含有的中子数为20NA
C. 1mol甲烷与1mol氯气光照条件下发生取代反应生成的CH3Cl的分子数一定为NA
D. 56gFe与酸反应转移的电子数一定为2NA
难度: 中等查看答案及解析
-
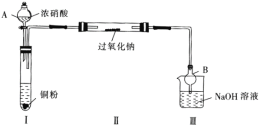
氯盐可导致混凝土中的钢筋腐蚀。为防止混凝土中的钢筋腐蚀,可在混凝土表面敷置一定电解质溶液并将惰性金属导电网浸泡其中,惰性金属导电网与钢筋分别连接外部直流电源从而除去Cl-,装置如图,下列说法错误的是
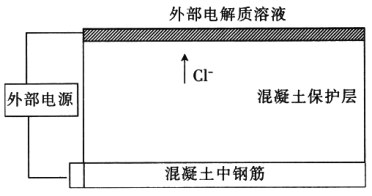
A. 钢筋接电源的正极
B. 金属导电网上发生的电极反应为2Cl—2e-=Cl2↑
C. 混凝土中的钙离子向钢筋方向移动
D. 电解一段时间后钢筋附近溶液的pH增大
难度: 中等查看答案及解析
-
下列操作、现象和结论均正确的是
选项
操作
现象
结论
A
将等体积等浓度的HX和HY与足量的锌反应,收集产生的氢气并记录其体积
HX收集到的氢气多
HX是强酸
B
向滴有酚酞的碳酸钠溶液中加入少量的氯化钡固体
红色变浅
碳酸钠溶液中存在水解平衡
C
向反应FeCl3+3KSCN
Fe(SCN)3+3KCl中加入KCl溶液
红色变浅
增大KCl的浓度,平衡逆向移动
D
常温下分别测量等浓度的K2SO3和KCl溶液的pH
pH:K2SO3>KCl
非金属性:Cl>S
A. A B. B C. C D. D
难度: 中等查看答案及解析