-
将0.01mol I2和0.01mol H2置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为456 kPa。体系中存在以下反应关系:
I2(g) 2I(g) △H1 Kp1=2.00
2I(g) △H1 Kp1=2.00
HI(g) I(g)+H(g) △H2 Kp2
I(g)+H(g) △H2 Kp2
H2(g) 2H(g) △H3 Kp3=8×10-6
2H(g) △H3 Kp3=8×10-6
I2(g)+H2(g) 2HI(g) △H4 Kp4
2HI(g) △H4 Kp4
回答下列问题:
(1) △H4与△H1、△H2、△H3的关系是_________________________。
(2) I2(g)+H2(g) 2HI(g)反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时,v正________(填“>”“<”“=”)v逆,前5minHI的生成率v(HI)=_____________________。
2HI(g)反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时,v正________(填“>”“<”“=”)v逆,前5minHI的生成率v(HI)=_____________________。
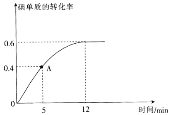
(3)达到平衡状态时,氢气的物质的量分数是________________;Kp4=________________(Kp为用平衡分压代替浓度表示的平衡常数,平衡分压=总压×物质的量分数)。
(4)下列说法能说明该体系达到平衡状态的是________________。
A.颜色不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.温度不再变化
(5)HI是一种强酸,常温下将1.0mol·L-1的HI溶液和amol·L-1的氨水等体积混合后,溶液呈中性此时溶液中离子浓度的大小关系是________________。
-
将 和
和 置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为
置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为 体系中存在以下反应关系:
体系中存在以下反应关系:



回答下列问题:
(1) 与
与 、
、 、
、 的关系是______。
的关系是______。
(2) 反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时
反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时 ______
______ 填“
填“ ”“
”“ ”或“
”或“ ”
” ,前
,前 的生成速率
的生成速率 ______。
______。
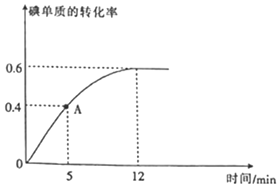
(3)达到平衡状态时,氢气的物质的量分数是______; ______;
______; ______
______ 保留2位有效数字
保留2位有效数字 为用平衡分压代替浓度表示的平衡常数,平衡分压
为用平衡分压代替浓度表示的平衡常数,平衡分压 总压强
总压强 物质的量分数
物质的量分数 。
。
(4)下列说法能说明该体系达到平衡状态的是______。
A.颜色不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.温度不再变化
(5) 是一种强酸,常温下将
是一种强酸,常温下将 的HI溶液和
的HI溶液和 的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
-
将 和
和 置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为
置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为 体系中存在以下反应关系:
体系中存在以下反应关系:



回答下列问题:
(1) 与
与 、
、 、
、 的关系是______。
的关系是______。
(2) 反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时
反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时 ______
______ 填“
填“ ”“
”“ ”或“
”或“ ”
” ,前
,前 的生成速率
的生成速率 ______。
______。
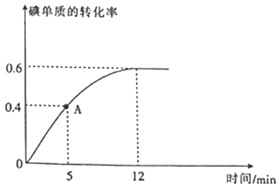
(3)达到平衡状态时,氢气的物质的量分数是______; ______;
______; ______
______ 保留2位有效数字
保留2位有效数字 为用平衡分压代替浓度表示的平衡常数,平衡分压
为用平衡分压代替浓度表示的平衡常数,平衡分压 总压强
总压强 物质的量分数
物质的量分数 。
。
(4)下列说法能说明该体系达到平衡状态的是______。
A.颜色不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.温度不再变化
(5) 是一种强酸,常温下将
是一种强酸,常温下将 的HI溶液和
的HI溶液和 的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
-
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中 假设容器体积不变,固体试样体积忽略不计
假设容器体积不变,固体试样体积忽略不计 ,使其达到分解平衡:
,使其达到分解平衡: 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
下列有关叙述正确的是
A.该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B.因该反应 、
、 ,所以在低温下自发进行
,所以在低温下自发进行
C.达到平衡后,若在恒温下压缩容器体积,体系中气体的浓度增大
D.根据表中数据,计算 时的分解平衡常数约为
时的分解平衡常数约为
-
(10分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数的测定。将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
(1)可以判断该分解反应已经达到化学平衡的是___________。
A.
B.密闭容器中总压强不变
C.密闭容器中混合气体的平均相对分子质量不变
D.密闭容器中气体密度不变
(2)根据表中数据,列式计算15.0℃时的分解平衡常数:__________________________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量______(填“增加”、“减小”或“不变”)。
(4)氨基甲酸铵分解反应的焓变△H____0,熵变△S___0(填>、<或=)。
-
将一定量的氨基甲酸铵固体置于特制的密闭真空容器中(容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的部分平衡数据如下表:
2NH3(g)+CO2(g)。实验测得不同温度下的部分平衡数据如下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | p1 | 12.0 | p2 | 24.0 |
| 平衡气体总浓度/10-3 mol·L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
下列说法中正确的是
A.混合气体的平均相对分子质量不再随时间变化时反应达平衡状态
B.15.0 ℃时NH2COONH4(s)分解的平衡常数为2.0×10-9 (mol/L)3
C.该反应∆H>0,p2=2p1
D.若在恒温下将平衡体系体积减半,再达平衡后,c(NH3)和c(CO2)均比原平衡大
-
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)  2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A 该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B 因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行
C根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol·L-1)3
D达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
-
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3 mol·L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B.因该反应熵变(ΔS)大于0,焓变(ΔH)大于0,所以在低温下自发进行
C.根据表中数据,计算15.0 ℃时的分解平衡常数约为2.0×10-9
D.达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
-
将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)  2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压 强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol· L-1 | 2.4× 10-3 | 3.4× 10-3 | 4.8× 10-3 | 6.8× 10-3 | 9.4× 10-3 |
(1)可以判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)根据表中数据,列式计算25.0 ℃时的分解反应平衡常数:_______________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将________(填“增加”、“减少”或“不变”)。
-
在373K 时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol/L。在60 s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法正确的是
A.前2 s,以N2O4浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
B.在2 s时,体系内压强为反应前的1.1倍
C.平衡时,体系内含N2O4 0.25 mol
D.平衡时,若往容器内充入氮气,则可提高N2O4的转化率
2I(g) △H1 Kp1=2.00
I(g)+H(g) △H2 Kp2
2H(g) △H3 Kp3=8×10-6
2HI(g) △H4 Kp4
2HI(g)反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时,v正________(填“>”“<”“=”)v逆,前5minHI的生成率v(HI)=_____________________。


