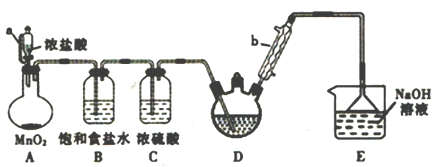
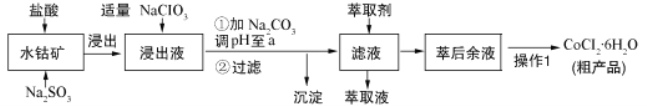
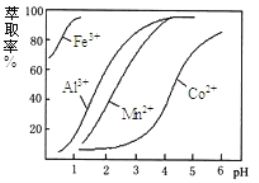
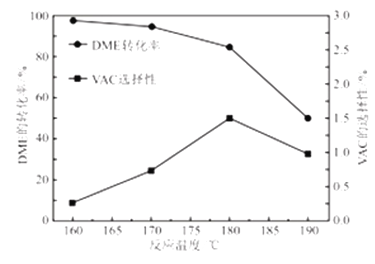
-
化学与生产和生活密切相关,下列有关说法正确的是( )
A. 英文的“中国”一词又指“瓷器”,中国瓷器驰名世界,其主要成分是SiO2
B. 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放人生石灰
C. 二氧化硫有毒,严禁将其添加到任何食品和饮料中
D. 泡沫灭火器中用的是小苏打和硫酸铝
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A. 硫化氢气体通入氯水中:H2S+Cl2=S↓+2Cl-+2H+
B. 向小苏打溶液中加入过量的石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
C. 氟气通入水中: 2F2+2H2O=4F-+4H++O2
D. FeBr2溶液与足量的Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
难度: 困难查看答案及解析
-
NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下.11.2L丙烷含有的极性键数目为5NA
B. 7g锂在空气中完全燃烧时转移的电子数为NA
C. 1mol葡萄糖(C6H12O6)分子含有的羟基数目为6NA
D. 常温下,0.2L0.5mol/LNH4NO3溶液中含有的氮原子数小于0.2NA
难度: 中等查看答案及解析
-
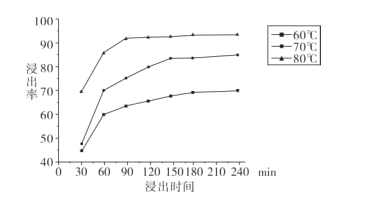
已知298K时,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0× 10-18,其沉淀溶解平衡曲线如图所示(图中R表示Ni或Fe),下列说法正确的是(已知:
≈2.4,
≈3.2) ( )
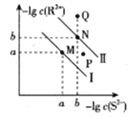
A. M点对应的溶液中,c(S2-)≈3.2×10-11 mol·L-1
B. 与P点相对应的NiS的分散系是均一稳定的
C. 向Q点对应的溶液中加水,可转化成N点对应的溶液
D. FeS+Ni2+
NiS+Fe2+的平衡常数K=6000
难度: 中等查看答案及解析
-
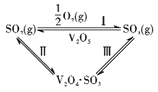
常温下,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中,分别加入NaOH的稀溶液,lg[c(H+)/c(OH-)]随加入NaOH的物质的量的变化如图所示。下列说法正确的是( )
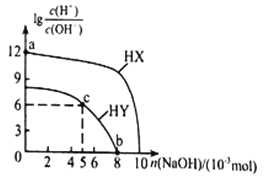
A. a点溶液的pH=2
B. c点溶液中:c(Yˉ)>c(Na+)>c(HY)>c(H+)>c(OHˉ)
C. b点溶液中:c(Yˉ)+c(HY)=c(Na+)
D. 水的电离程度:a<b<c
难度: 中等查看答案及解析
-
已知亚硒酸(H2SeO3)为二元弱酸,常温下,向某浓度的亚硒酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中H2SeO3、HSeO3-、SeO32-三种微粒的物质的量分数与溶液pH 的关系如图所示。下列说法不正确的是
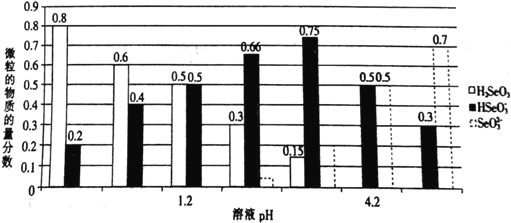
A. 常温下,亚硒酸的电离平衡常数K2=10-4.2
B. pH=l.2的溶液中:c(Na+)+c(H+)=c(OH-)+c(H2SeO3)
C. 将相同物质的量NaHSeO3和Na2SeO3 固体完全溶于水可配得pH为4.2的混合液
D. 向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中水的电离程度一直增大
难度: 困难查看答案及解析
-
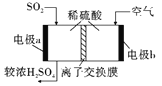
微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图为其工作原理和废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是
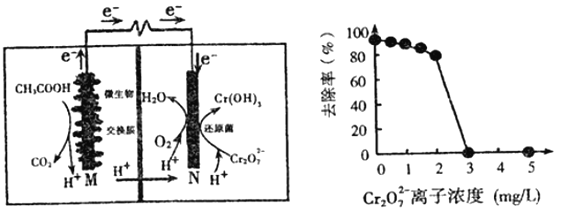
A. 反应一段时间后,N极附近的溶液pH下降
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. Cr2O72-离子浓度较大时,可能会造成还原菌失活
D. M为电池正极,CH3COOH被还原
难度: 困难查看答案及解析