-
电解法生产锰时会产生大量的阳极泥,其主要成分为MnO2和Pb,还含有少量其他金属化合物。下图是回收电解锰阳极泥生产MnCO3的工艺流程。

已知:Al(OH)3、Mn(OH)2、MnCO3的Ksp分别为1.0×10-33、1.9×10-13、2.2×10-11。
(l)“还原酸浸”时氧化产物为CO2,发生反应的化学方程式为____。
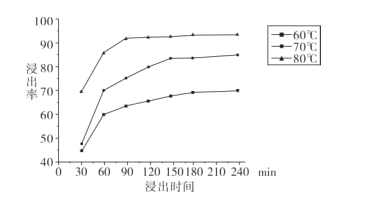
(2)“还原酸浸”实验中,锰的浸出率结果如图所示。由图可知,所采用的最佳实验条件为 ____ 。
(3)滤液l中的阳离子组成见下表:
| 组成 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
| 浓度/(mol·L-1) | 0.85 | 2.4×10-3 | 1.0×10-2 | 2.0×10-3 |
“除杂”时先加MnO2,MnO2的作用为 ___。
再加氨水调节pH使杂质离子沉淀完全,通过计算说明Al3+沉淀完全时Mn2+是否开始沉淀 ___。
(4)“沉锰”时发生反应的离子方程式为 ___。
(5)“沉锰”的关键操作有2点:①将NH4HCO3溶液滴入MnSO4溶液中;②反应终点pH=7。如果颠倒试剂滴加顺序,将MnSO4溶液滴人NH4HCO3,溶液中,或反应终点pH>7可能造成同样的后果,该后果是____;如粜反应终点pH<7,可能的后果是______。
(6)从滤液2中回收得到的副产品的用途为________。
-
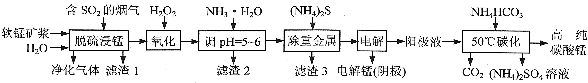
工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
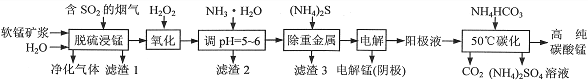
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为______________________。
(2)“滤渣2”中主要成分的化学式为______________________。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是_______________________________________。
(4)“电解”时用惰性电极,阳极的电极反应式为____________________________。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为_______________________________________。“50℃碳化”时加入过量NH4HCO3,可能的原因是______________________________________(写两种)。
(6)已知:25℃时,KW=1.0×10-14,Kb(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O NH3·H2O+H+,则该反应的平衡常数为____________________。
NH3·H2O+H+,则该反应的平衡常数为____________________。
-
工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
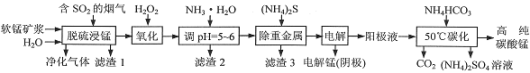
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为__。
(2)“滤渣2”中主要成分的化学式为__。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是__。
(4)“电解”时用惰性电极,阳极的电极反应式为__。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为___。“50℃碳化”时加入过量NH4HCO3,可能的原因是__(写两种)。
(6)已知:25℃时,Kw=1.0×10-14,Ka(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:NH4++H2O NH3·H2O+H+,则该反应的平衡常数为__。
NH3·H2O+H+,则该反应的平衡常数为__。
-
工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
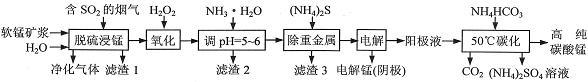
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为______________________。
(2)“滤渣2”中主要成分的化学式为______________________。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是_______________________________________。
(4)“电解”时用惰性电极,阳极的电极反应式为____________________________。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为_______________________________________。“50℃碳化”时加入过量NH4HCO3,可能的原因是______________________________________(写两种)。
(6)已知:25℃时,KW=1.0×10-14,Kb(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O NH3·H2O+H+,则该反应的平衡常数为____________________。
NH3·H2O+H+,则该反应的平衡常数为____________________。
-
工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为 。
(2)“滤渣2”中主要成分的化学式为 。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是 。
(4)“电解”时用惰性电极,阳极的电极反应式为 。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为 。“50℃碳化”时加入过量NH4HCO3,可能的原因是:使MnSO4充分转化为MnCO3; ; 。
-
(16分) 以电解法生产金属锰产生的阳极泥中,其锰含量高达40%~50%,主要成分为MnO2的水合物,且含有显著量的Pb2+、Sn2+等重金属杂质。本工艺采用的木屑富含的纤维素在较浓硫酸的作用下膨胀、水解生成还原糖,酸性条件下,可与二氧化锰反应生成可溶性的硫酸锰。
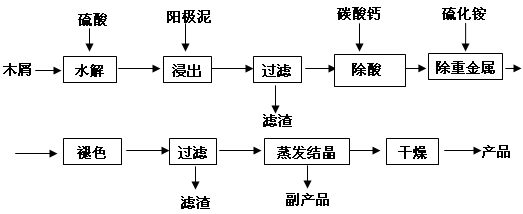
(1)工业上电解硫酸锰的水溶液生产金属锰,阳极的电极反应式为 。
(2)写出木屑水解反应的化学方程式: 。配平浸出步骤反应方程式C6H12O6 + MnO2 + H2SO4→ MnSO4 + CO2 + H2O
(3)若取消除酸操作步骤,将会产生 气体(填化学式)而污染环境;
(4)本工艺的一种副产品是重要的农业生产资料,写出其化学式 ;
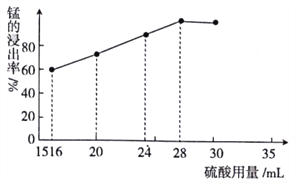
(5)取一定量的阳极泥进行实验分析,得到如下图像。硫酸的最合适用量为 mL,若再增加硫酸的用量,将会导致 (填化学式)的消耗量增大。

(6)某阳极泥中MnO2(相对分子质量为87)的质量分数为50.0%,将174g该阳极泥与320g36.5%的浓盐酸混合加热,则产生的氯气在标准状况下应少于 L。(假设阳极泥中的其它成分不参与反应)
-
以电解法生产金属锰产生的阳极泥中,其锰含量高达40%~50%,主要成分为MnO2的水合物,且含有显著量的Pb2+、Sn2+等重金属杂质。本工艺采用富含纤维素的木屑在较浓硫酸的作用下,膨胀、水解,生成葡萄糖;酸性条件下,葡萄糖与阳极泥中的二氧化锰反应生成可溶性的硫酸锰。
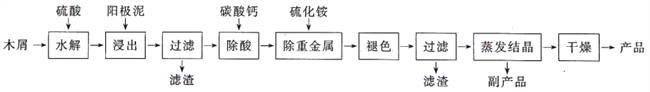
回答下列问题:
(1)工业上电解硫酸锰的水溶液生产金属锰,阳极的电极反应式为__________。
(2)配平“浸出”步骤中发生反应的化学方程式:C6 H12O6+_____MnO2+_____H2SO4=____MnSO4+____CO2↑+____H2O,_____________________
(3)若取消“除酸”操作步骤,将会产生______气体(写化学式)而污染环境。
(4)本工艺的一种副产品是重要的农业生产资料,写出其化学式:__________。
(5)取一定量的阳极泥进行实验分析,得到如右图象。硫酸的最合适用量为_____mL,若再增加硫酸的用量,将会导致________。(写化学式)的消耗量增大。
(6)某阳极泥中MnO2的质量分数为50.0%,将174 g该阳极泥与320 g浓盐酸(溶质质量分数为36.5%)混合加热,则产生的氯气在标准状况下应少于_____L(精确到0.1,假设阳极泥中的其他成分不参与反应)。
-
硒(Se)、碲(Te)为VIA族元素,是当今高新技术新材料的主要成分之一,电解精炼铜的阳极泥主要成分为Cu2Te、Ag2Se和少量金属单质及其他化合物,工业上从其中回收碲、硒的一种工艺流程如下:

已知:
I.Se 单质难溶于水。TeO2微溶于水,易溶于较浓的强酸和强碱;
II.元素碲在溶液中主要以Te4+、TeO32-、HTeO3-等形式存在;
III.25℃时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8。
(1)Se的氢化物的电子式是_______________。0.1mol/L的H2TeO3电离度(当弱电解质在溶液里达到电离平衡时,溶液中已经电离的电解质分子数占原来总分子数的百分数叫做电离度) 约为_____________________。
(2) 加入浓硫酸焙烧前常将阳极泥中大块颗粒先粉碎,其目的是_______________________。
(3) SeO2 与SO2在冷却后通入水中反应的化学方程式_________________________________。反应后分离出Se单质的操作①为_________________(填操作名称)。
(4)焙砂中碲以TeO2形式存在,与足量NaOH溶液反应后得到的溶液①,其溶质的主要成分为_______(填化学式,过量的NaOH除外)。工业上也可以通过电解溶液①得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为__________________________________。
(5)向溶液①中加入硫酸时控制溶液的pH 为4.5~5.0,生成TeO2沉淀,如果H2SO4过量,将导致碲的回收率__________(填“偏高”、“偏低”或“无影响”)。
(6)将纯净的TeO2先溶于盐酸得到四氯化碲,然后再将SO2通入到溶液中得到Te单质,请写出由四氯化碲得到Te单质的离子方程式________________________________。
(7)上述流程中可循环利用的物质_______________(填化学式)。
-
硒(Se)、碲(Te)为VIA族元素,是当今高新技术新材料的主要成分之一,电解精炼铜的阳极泥主要成分为Cu2Te、Ag2Se和少量金属单质及其他化合物,工业上从其中回收碲、硒的一种工艺流程如下:

已知:
I.Se 单质难溶于水。TeO2微溶于水,易溶于较浓的强酸和强碱;
II.元素碲在溶液中主要以Te4+、TeO32-、HTeO3-等形式存在;
III.25℃时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8。
(1)Se的氢化物的电子式是_______________。0.1mol/L的H2TeO3电离度(当弱电解质在溶液里达到电离平衡时,溶液中已经电离的电解质分子数占原来总分子数的百分数叫做电离度) 约为_____________________。
(2) 加入浓硫酸焙烧前常将阳极泥中大块颗粒先粉碎,其目的是_______________________。
(3) SeO2 与SO2在冷却后通入水中反应的化学方程式_________________________________。反应后分离出Se单质的操作①为_________________(填操作名称)。
(4)焙砂中碲以TeO2形式存在,与足量NaOH溶液反应后得到的溶液①,其溶质的主要成分为_______(填化学式,过量的NaOH除外)。工业上也可以通过电解溶液①得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为__________________________________。
(5)向溶液①中加入硫酸时控制溶液的pH 为4.5~5.0,生成TeO2沉淀,如果H2SO4过量,将导致碲的回收率__________(填“偏高”、“偏低”或“无影响”)。
(6)将纯净的TeO2先溶于盐酸得到四氯化碲,然后再将SO2通入到溶液中得到Te单质,请写出由四氯化碲得到Te单质的离子方程式________________________________。
(7)上述流程中可循环利用的物质_______________(填化学式)。
-
电解精炼铜的阳极泥中主要含Ag、Au等贵重金属,还含有少量 CeF4。以下是从精炼铜的阳极泥中回收银、金的流程图:
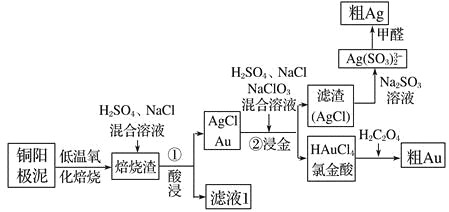
已知:①Ce 常见的化合价为+3、+4 价;②CeF4 很稳定,1000℃ 时仍不分解。
(1)①酸浸步骤中有少量黄绿色气体生成,滤液 1 中含有CeCl3,写出焙烧渣酸浸生成 CeCl3的化学方程式_________________________________________ 。
(2)铜阳极泥氧化时,采用“低温焙烧”而不采用“高温焙烧”的原因是__________
(3)“②浸金”反应中, H2SO4 的作用为_________________________,该步骤的分离操作中, 需要对所得的 AgCl 进行水洗。判断 AgCl 已经洗涤干净的方法是:取最后一次洗涤液,滴________________________试剂,出现_______现象,证明 AgCl 未洗涤干净。
(4)氯金酸(HAuCl4)在 pH 为 2~3 的条件下被草酸还原为 Au,同时放出二氧化碳气体,写出该反应方程式_____________________________________________
(5)甲醛还原法沉积银,(Ag(SO3 )2 3-)通常是在搅拌下于室温及弱碱性条件下进行,甲醛被氧化为碳酸氢根离子,则该反应的离子方程式为 _______________
(6)电解法精炼银,用 10A 的电流电解 30min,若电解效率(通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比)为 80%,此时可得到银单质的质量为__________ (保留 1 位小数,法拉第常数 96500C/mol)。












