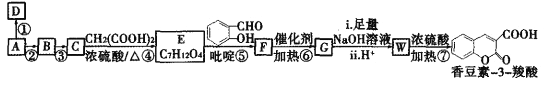
-
化学与我们的生活息息相关,下列有关说法不正确的
A. 推广使用可降解的淀粉塑料和提倡使用乙醇汽油,都能减轻环境污染
B. 煤经过气化和液化等物理变化后,可得到清洁燃料
C. 中国国产航母使用了大量的合金,合金具有强度大、抗蚀等优点
D. 石墨烯电池能够闪充,是利用单层石墨烯表面积大的特点
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法不正确的是
A. 60g由冰醋酸和葡萄糖组成的混合物中含有氢原子的数目为4NA
B. 常温下,10g氖气中所含有的氖原子数目为0.5NA
C. 将3 mol H2和1molN2混合充分反应后,容器内分子数等于2NA
D. 标准状况下,2.24LSO2和O2的混合气体充分反应后,混气中含有的氧原子总数为0.2NA
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A. (CH3)3C-CH=CH2与氢气完全反应后,生成2,2,3-三甲基戊烷
B. 工业上由乙烯制乙醇、苯制环己烷均属于加成反应
C. C5H11Cl的同分异构体有3种
D.
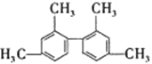 分子中所有碳原子一定在同一平面上
分子中所有碳原子一定在同一平面上难度: 中等查看答案及解析
-
下列实验操作、现象、得出的结论均正确的是
选项
实验操作和现象
结论
A
某溶液
生成使石灰水变浑浊的无色气体
原溶液中一定含有CO32-
B
用湿润的pH试纸测某碱液的pH,测定值偏小
湿润的pH试纸测量任何溶液都会产误差
C
将浓硫酸倒入蔗糖中搅拌蔗糖迅速变黑并伴有刺激性气味
浓硫酸具有脱水性和强氧化性
D
将乙烯和苯分别加入到溴水中,都能使溴水层褪色
乙烯和苯分子中都含有碳碳双键
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
a、b、c、d原子序数依次增大,且均不大于20。c的单质在常温下为有色气体,在工业上常与d的最高价氧化物对应的水化物反应生产漂白粉;同时该气体与a、b形成的一种化合物反应生成两种酸。下列说法正确的是
A. 原子半径大小为:a<b<d<c
B. a与b、c、d形成的二元化合物均为共价化合物
C. 向漂白粉中加入稀硫酸,能产生c的单质
D. 最简单氢化物水溶液的pH:d<c
难度: 中等查看答案及解析
-
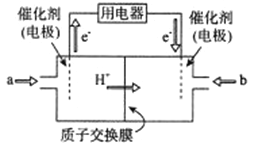
工业上用Na2SO3溶液处理硫酸厂的废气SO2得 NaHSO3溶液,然后用惰性电极电解 NaHSO3废水(原理如图所示)使吸收液再生,两膜中间的Na+和HSO3-可通过离子交换膜。下列叙述正确的是

A. 通电后中间隔室的HSO3-离子通过C膜向左侧迁移,左侧电极室溶液pH增大
B. 图中A连接电源的正极,B连接电源的负极
C. 阳极反应为HSO3-+H2O-2e-=SO42-+3H+,阳极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的Na2SO3生成
难度: 困难查看答案及解析
-
25℃时,NiS、FeS沉淀溶解平衡曲线如图所示(已知NiS的溶解度比FeS小,lg2=0.3),图中p(S2-)=-lgc(S2-)、p(M2+)=-lgc(M2+),M表示Ni或Fe,下列说法不正确的是
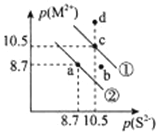
A. 曲线①表示的是NiS
B. d点分别对应的NiS和FeS的分散系均是均一稳定的
C. 25℃时,FeS+Ni2+
NiS+Fe2+的平衡常数K=4000
D. 向a点溶液中加入硫化钠,可变为b点溶液
难度: 困难查看答案及解析