-
已知:25 ℃时,Mg(OH)2的Ksp=5.61×10-12,MgF2的Ksp=7.42×10-11。下列判断正确的是
A. 25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B. 25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C. 25 ℃时,Mg(OH)2固体在20 mL 0.01 mol/L的氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的Ksp小
D. 25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
难度: 中等查看答案及解析
-
已知热化学方程式:H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 mol·L-1;1/2H2SO4(浓)+NaOH(aq)===1/2Na2SO4(aq)+H2O(l) ΔH2=m,下列说法正确的是
A. 上述热化学方程式中的计量数表示分子数
B. ΔH1>ΔH2
C. ΔH2=-57.3 kJ·mol-1
D. |ΔH1|>|ΔH2|
难度: 中等查看答案及解析
-
一定条件下,碳钢腐蚀与溶液pH的关系如下:
pH
2
4
6
6.5
8
13.5
14
腐蚀快慢
较快
慢
较快
主要产物
Fe2+
Fe3O4
Fe2O3
FeO
下列说法不正确的是
A. 在pH<4的溶液中,碳钢主要发生析氢腐蚀
B. 在pH>6的溶液中,碳钢主要发生吸氧腐蚀
C. 在pH>14的溶液中,碳钢腐蚀的正极反应为O2+4OH-+4e-===2H2O
D. 在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减慢
难度: 困难查看答案及解析
-
下列过程伴随的能量变化中,属于反应热的是
A. 形成1 mol H—Cl键放出的能量
B. 石墨转变成金刚石吸收的能量
C. 1 mol O2形成2 mol O原子吸收的能量
D. 水蒸气变成液态水放出的能量
难度: 中等查看答案及解析
-
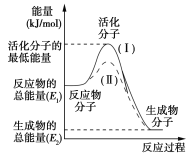
某化学反应的能量变化如下图所示。下列有关叙述正确的是

A. 该反应的反应热ΔH=E2-E1
B. a、b分别对应有催化剂和无催化剂的能量变化
C. 催化剂能降低反应的活化能
D. 催化剂能改变反应的焓变
难度: 简单查看答案及解析
-
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随
的变化如图所示,下列叙述错误的是( )

A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当
=2时,若两溶液同时升高温度,则
增大
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B. 水电离出的c(H+)=10-12 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C. c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl-
D. c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
难度: 中等查看答案及解析
-
一定条件下,在恒容密闭容器中,能表示反应X(气)+2Y(气)
2Z(气)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A. ①② B. ①④ C. ②③ D. ③④
难度: 中等查看答案及解析
-
关于如图中四个图像的说法正确的是
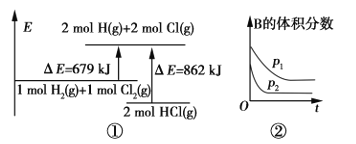
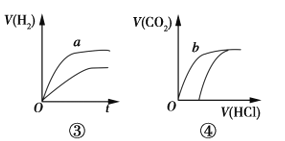
注:图中,E表示能量,p表示压强,t表示时间,V表示体积。
A. ①表示化学反应H2(g)+Cl2(g)===2HCl(g)的能量变化,则该反应的反应热ΔH=183 kJ/mol
B. ②表示其他条件不变时,反应4A(g)+3B(g)
2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是气体
C. ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液
D. ④表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液
难度: 困难查看答案及解析
-
已知反应A(g)+B(g)
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃
700
830
1200
K值
1.7
1.0
0.4
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1
难度: 中等查看答案及解析
-
常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
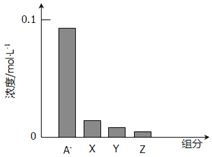
A. HA是强酸
B. 该混合液pH=7
C. 图中x表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=c(Na+)
难度: 中等查看答案及解析
-
下列说法正确的是
A. 水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B. Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C. 常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH4+)/c(NH3·H2O)的值增大
D. 室温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等
难度: 中等查看答案及解析
-
常温下,将浓度均为0.1 mol/L HA溶液和NaOH溶液等体积混合,混合溶液的pH=9,下列说法正确的是
A. 该混合溶液中:c(A-)>c(Na+)>c(OH-)>c(H+)
B. 该混合溶液中:c(HA)+c(A-)=0.1 mol/L
C. 常温下,0.1 mol/L HA溶液的pH=1
D. 0.1 mol/L HA溶液中:c(HA)>c(A-)
难度: 中等查看答案及解析
-
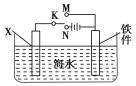
根据如图回答,下列说法不正确的是
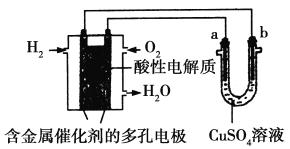
A. 此装置用于铁表面镀铜时,a为铁
B. 此装置用于电镀铜时,硫酸铜溶液的浓度不变
C. 燃料电池中正极反应为1/2O2+2e-+2H+===H2O
D. 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜
难度: 困难查看答案及解析
-
纯净物X、Y、Z转化关系如图所示,下列判断正确的是( )

A. X可能是金属铜 B. Y不可能是氢气
C. Z可能是氯化钠 D. Z可能是三氧化硫
难度: 困难查看答案及解析
-
已知某温度、压强下的气体摩尔体积为55.20 L·mol-1,在该条件下有1 mol气体X发生如下反应并达到平衡:2X(g)
mY(g)+Z(g),测得混合气体中X的体积分数为58.80%,混合气体的总质量为46.00 g,混合气体的密度为0.72 g·L-1。则平衡时混合气体的平均相对分子质量为
A. 58.80 B. 46.00
C. 39.74 D. 16.13
难度: 中等查看答案及解析
-
温度为T时,向4.0 L恒容密闭容器中充入2.0 mol PCl5,反应PCl5(g)
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s
0
50
150
250
350
n(PCl3)/mol
0
0.32
0.38
0.40
0.40
下列说法正确的是
A. 反应在前50 s的平均速率为v(PCl3)=0.006 4 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,则此反应的化学平衡常数为1/40
D. 相同温度下,起始时向容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)<v(逆)
难度: 困难查看答案及解析
-
用标准盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )
A. 用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B. 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C. 用碱式滴定管取10.00 mL NaOH溶液放入蒸馏水洗净的锥形瓶中,加入少量的蒸馏水再进行滴定
D. 用酚酞作指示剂滴至红色刚变无色时即停止加盐酸
难度: 中等查看答案及解析
 ,据此回答以下问题:
,据此回答以下问题: