-
温度为T时,在4.0 L恒容密闭容器中充入2.0 mol PCl5,发生反应:
PCl5(g) PCl3(g)+Cl2(g),反应时间(t)与容器内气体总压强(p)的数据见下表:
PCl3(g)+Cl2(g),反应时间(t)与容器内气体总压强(p)的数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| 总压强p/100kPa | 100 | 116 | 119 | 120 | 120 |
(1)由总压强p和起始压强p0计算反应物PCl5的转化率α(PCl5)的表达式为?平衡时PCl5的转化率为多少?
(2)反应在前50 s的平均速率v(PCl3)为多少?
(3)该温度下 的平衡常数为多少?
的平衡常数为多少?
-
某温度下,向4.0 L恒容密闭容器中充入2.0 mol PCl5,反应PCl5(g)  PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| 时间/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是( )
A.反应在前50 s的平均反应速率为v(PCl3)=0.006 4 mol/(L·s)
B.相同温度下,起始时向该容器中充入2.0 mol PCl5、0.4 mol PCl3和0.40 mol Cl2,达到平衡前v(正)>v(逆)
C.相同温度下,起始时向该容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
D.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则反应的ΔH<0
-
某温度下,向4.0 L恒容密闭容器中充入2.0 mol PCl5,反应PCl5(g)  PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| 时间/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是( )
A.反应在前50 s的平均反应速率为v(PCl3)=0.006 4 mol/(L·s)
B.相同温度下,起始时向该容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
C.相同温度下,起始时向该容器中充入2.0 mol PCl5、0.4 mol PCl3和0.40 mol Cl2,达到平衡前v(正)>v(逆)
D.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则反应的ΔH<0
-
温度为T时,向4.0 L恒容密闭容器中充入2.0 mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是
A. 反应在前50 s的平均速率为v(PCl3)=0.006 4 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,则此反应的化学平衡常数为1/40
D. 相同温度下,起始时向容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)<v(逆)
-
4.0mol PCl3和2.0mol Cl2充入体积不变的密闭容器中,一定条件下发生下述反应:PCl3(g)+Cl2(g)  PCl5(g) 达到平衡后,PCl5为0.8 mol,如果此时再充入4.0mol PCl3和2.0mol Cl2,相同温度下再达到平衡时PCl5的物质的量是( )
PCl5(g) 达到平衡后,PCl5为0.8 mol,如果此时再充入4.0mol PCl3和2.0mol Cl2,相同温度下再达到平衡时PCl5的物质的量是( )
A.1.6mol B.小于1.6mol C.0.8mol D.大于1.6mol
-
将4.0 mol PCl3和2.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g) PCl5(g)。达到平衡时,PCl5为0.8mol,如果此时移走2.0molPCl3 和1.0mol Cl2,在相同温度下再达到平衡时PCl5的物质的量是
PCl5(g)。达到平衡时,PCl5为0.8mol,如果此时移走2.0molPCl3 和1.0mol Cl2,在相同温度下再达到平衡时PCl5的物质的量是
A. 0.8mol B. 0.4mol C. 小于0.4mol D. 大于0.4mol,小于0.8mol
-
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)达到平衡时,测得PCl3为0.2 mol,如果此时再向容器中充入1.0 mol PCl3 和1.0 mol Cl2,在相同温度下再次达平衡时,PCl3 的物质的量是
PCl3(g)+Cl2(g)达到平衡时,测得PCl3为0.2 mol,如果此时再向容器中充入1.0 mol PCl3 和1.0 mol Cl2,在相同温度下再次达平衡时,PCl3 的物质的量是
A. 0.2 mol B. 大于0.4mol
C. 0.4 mol D. 大于0.2 mol,小于0.4 mol
-
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,发生反应:
PCl5(g)=====PCl3(g)+Cl2(g) △H=akJ/mol(a>0)
0~10min保持容器温度不变,10min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。下列说法正确的是
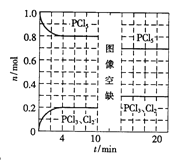
A.0~4min的平均速率v(Cl2)=0.05mol/(L·min )
B.10min时改变的条件是分离出一定量的PCl5
C.起始时向该容器中充入2.0mol PCl3和2.0molCl2,保持温度为T,反应达平衡时放出的热量大于1.6akJ
D.温度为T,起始时向该容器中充入1.0mol PCl5、0.10mol PCl3和0.10molCl2,反应达到平衡前,v(正)>v(逆)
-
向2.0L恒容密闭容器中充入1.0mol PCl5,在温度为T时发生如下反应PCl5(g) PCl3(g)+ Cl2(g)△H= +124 kJ•mol-1。反应过程中测定的部分数据见下表:
PCl3(g)+ Cl2(g)△H= +124 kJ•mol-1。反应过程中测定的部分数据见下表:

回答下列问题:
(1)反应在前50s的平均速率v(PCl5)= ,该反应的△S 0(填“<”、“>”或“=”).
(2)温度为T时,该反应的化学平衡常数= 。
(3)上述反应到达平衡状态时,PCl3的体积分数为 。
要提高平衡时PCl3的体积分数,可采取的措施有 。
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a= 。
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是 。
-
一定温度下,在三个体积均为2.0L的恒容密闭容器中发生如下反应:PCl5(g)═PCl3(g)+Cl2(g)
| 编号 | 温度(℃) | 起始物质的量
(mol) | 平衡物质的量
(mol) | 达到平衡所需时间
(s) | |
| PCl5(g) | PCl3(g) | Cl2(g) |
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | | | t2 |
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是
A. 平衡常数K:容器Ⅱ>容器Ⅲ
B. 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C. 反应到达平衡时,容器I中的平均速率为v(PCl5)=0.1/t1mol/(L•s)
D. 起始时向容器Ⅲ中充入PCl50.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:

