-
下列设备工作时,将化学能转化为热能的是( )
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
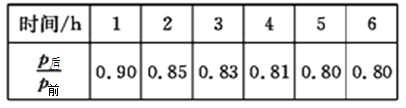
由硫酸钾、硫酸铝和硫酸组成的混合溶液,pH=1,c(Al3+)=0.4mol·L-1,c(SO42—)=0.8mol·L-1,则c(K+)为( )
A. 0.4mol·L-1 B. 0.2mol·L-1 C. 0.15mol·L-1 D. 0.3mol·L-1
难度: 简单查看答案及解析
-
下列操作中,能使电离平衡H2O
H+ + OH-正向移动且溶液呈酸性的是( )
A. 向水中加入NaHSO4溶液 B. 向水中加入Al2(SO4)3溶液
C. 向水中加入Na2CO3溶液 D. 将水加热到100℃,使水的pH=6
难度: 简单查看答案及解析
-
下列解释事实的反应方程式不正确的是( )
A. 向碳酸钠溶液中滴加酚酞溶液,溶液变红:CO32-+2H2O
H2CO3+ 2OH-
B. 以Na2S为沉淀剂,除去溶液中的Cu2+:Cu2+ + S2-===CuS↓
C. 向AgCl沉淀中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-
Ag2S+2Cl-
D. 向KI溶液中滴加稀硫酸和淀粉溶液,放置在空气中溶液变蓝:4H++4I-+O2=== 2I2 + 2H2O
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 氢氧燃料电池放电时化学能全部转化为电能
B. 3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
C. 反应4Fe(s)+3O2(g)= 2Fe2O3(s)常温下可自发进行,该反应为吸热反应
D. 向某溶液中滴加K3[Fe(CN)6]溶液产生蓝色沉淀,说明该溶液中有Fe2+,无Fe3+
难度: 简单查看答案及解析
-
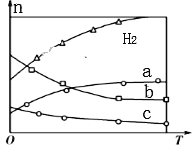
在密闭容器中进行反应:A(g)+3B(g)
2C(g),有关下列图象的说法不正确的是( )
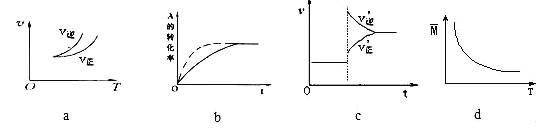
A. 依据图a可判断正反应为放热反应
B. 在图b中,虚线可表示使用了催化剂
C. 若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动
D. 由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0
难度: 简单查看答案及解析
-
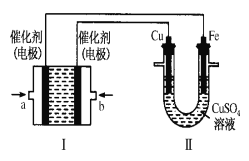
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述不正确的是( )
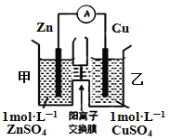
A. Zn电极上发生氧化反应
B. 电池工作后,甲池的SO42-微粒数减少
C. 电池工作后,甲池溶液的阳离子移动到乙池
D. 电池工作后,乙池中的Cu电极质量增加
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)=c(NH4+)
B. 向0.1mol•L−1CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
C. 常温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,混合溶液呈酸性
D. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO—)/c(CH3COOH)·c(OH—)增大
难度: 中等查看答案及解析
-
一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g)
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min)
0
t1
t2
t3
NH3物质的量(mol)
0
0.2
0.3
0.3
A. 0〜t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g)
2NH3(g)的活化能小于2NH3(g)
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
难度: 中等查看答案及解析
-
H2和I2在一定条件下能发生反应:H2(g)+I2(g)
2HI(g)△H=—a kJ/mol,下列说法正确的是( )
已知:
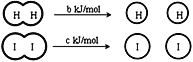 (a、b、c均大于零)
(a、b、c均大于零)A. H2、I2和HI分子中的化学键都是非极性共价键
B. 断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ
C. 相同条件下,1 mol H2 (g)和1mol I2 (g)总能量小于2 mol HI (g)的总能量
D. 向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ
难度: 中等查看答案及解析
-
科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列说法不正确的是( )
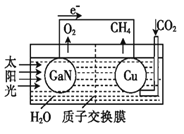
A. 该过程是将太阳能转化为化学能的过程
B. GaN表面发生氧化反应:2H2O-4 e-===O2↑+4H+
C. Cu表面的反应是:CO2+8e-+6H2O ===CH4+8OH¯
D. H+透过质子交换膜从左向右迁移
难度: 简单查看答案及解析
-
在密闭容器中一定量的混合气体发生反应:xA(g)+yB(g)
zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L.下列有关判断正确的是( )
A. 平衡向正反应方向移动 B. B的转化率降低
C. x+y<z D. C的体积分数增大
难度: 简单查看答案及解析
-
下列各组离子能在指定溶液中大量共存的是( )
A. 无色溶液中:Al3+、NH4+、Cl‾、HCO3‾
B. 室温下水电离的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
C. 室温下c(H+)/c(OH-)=1012的溶液中:Fe2+、Al3+、NO3-、I-
D. pH=14的溶液中:CO32-、Na+、Cl-、AlO2-
难度: 简单查看答案及解析
-
下列图中的实验方案,能达到实验目的的是( )
实验方案
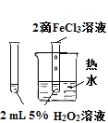
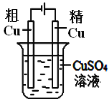

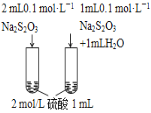
目的
A.验证升高温度可加快H2O2分解
B.精练铜
C.验证AgCl沉淀
可以转变为Ag2S
D.探究浓度对化学
反应速率的影响
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列有关热化学方程式的叙述中,正确的是( )
A. 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热化学方程式为 NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.4 kJ/mol
B. 已知2C(s)+2O2(g)===2CO2(g) ΔH1, 2C(s)+O2(g)===2CO(g) ΔH2;则ΔH1<ΔH2
C. 已知2H2(g)+O2(g)===2H2O(g) ΔH =-483.6 kJ/mol,则H2的燃烧热为241.8 kJ/mol
D. 已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
难度: 简单查看答案及解析
-
常温下,0.1 mol·L-1某一元酸(HA)溶液的pH=3.下列叙述正确的是( )
A. 该溶液中:2c (H+)= c(A-)+c(OH-)
B. 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
C. 浓度均为0.1 mol·L-1的HA和NaA溶液等体积混合,所得溶液显酸性,则:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+)
D. 0.1 mol·L-1 HA溶液与0.05 mol·L-1 NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)==c(A-)+2c(OH-)
难度: 简单查看答案及解析