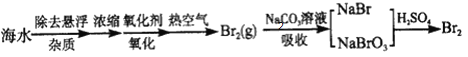-
某无色透明的强酸性溶液中,能大量共存的一组离子是
A. Mg2+、A13+、SO42-、NO3- B. Na+、HCO3-、K+、SO42-
C. MnO4-、K+、SO42-、Na+ D. NH4+、Fe2+、Cl-、NO3-
难度: 中等查看答案及解析
-
《本草图经》中关于绿矾的分解有如下描述:“绿矾形似朴消(Na2SO4·10H2O)而绿色,取此物置于铁板上,聚炭,封之囊袋,吹令火炽,其矾即沸,流出,色赤如融金汁者是真也。”对此段话的说明中肯定错误的是( )
A. 绿矾的化学式为FeSO4·7H2O B. 绿矾分解过程中没有发生电子的转移
C. “色赤”物质可能是Fe2O3 D. 流出的液体中可能含有硫酸
难度: 困难查看答案及解析
-
化学与生活密切相关,下列有关说法正确的是( )
A. 氢氧化铁胶体具有很强的吸附性,可用于自来水的杀菌消毒
B. SiO2晶体熔点高硬度大,可用作芯片和太阳能电池
C. NaClO具有强氧化性,可作织物漂白剂
D. PM2.5指直径小于或接近2.5微米的颗粒物,在空气中能产生丁达尔现象
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. Fe
FeCl2
Fe(OH)2
B. S
SO3
H2SO4
C. NH4Cl(s)
NH3
Mg(OH)2
D. SiO2
H2SiO3
Na2SiO3
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 7.8g Na2O2与足量水反应生成O2分子数为0.1NA
B. 50mL 18mol/L H2SO4溶液与足量的铜反应能产生SO2气体分子数为0.45NA
C. 标准状况下22.4 L氯气与足量的铁反应,转移电子数为3NA
D. 常温常压下,92g NO2气体中含有的原子总数为6NA
难度: 中等查看答案及解析
-
最近,科学家开发出一种低成本光伏材料——蜂窝状石墨烯。生产原理是:
Na2O + 2CO
Na2CO3 + C(石墨烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是( )
A. 该生产石墨烯的反应属于氧化还原反应
B. 石墨烯与金刚石互为同素异形体
C. Na2O属于碱性氧化物,CO属于酸性氧化物,Na2CO3属于盐
D. 自然界中碳元素有游离态和化合态两种存在形式
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式的是 ( )
A. Na2SiO3溶液中加入盐酸: SiO32ˉ +2H+ = H2SiO3↓
B. Ba(OH)2溶液与NH4Cl稀溶液反应:NH4+ + OHˉ = NH3↑ + H2O
C. FeCl3溶液中加入铁粉: Fe3+ + Fe = 2Fe2+
D. NaHCO3与烧碱溶液反应:HCO3ˉ+ OHˉ = CO2↑+H2O
难度: 中等查看答案及解析
-
下列反应中,水作氧化剂的是( )
A. SO3 + H2O = H2SO4 B. 2Na+2H2O = 2NaOH + H2↑
C. 2F2 +2H2O = 4HF +O2 D. 3NO2 + H2O = 2HNO3+NO↑
难度: 中等查看答案及解析
-
下列有关物质的分类或性质与应用均正确的是 ( )
A. SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力
B. Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒
C. MgO、Al2O3的熔点很高,二者都可用于制作耐高温材料
D. NO2、SO2两种气体都能与水反应生成酸,它们都是酸性氧化物
难度: 中等查看答案及解析
-
如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( )

选项
试剂
现象
结论
A
酸性KMnO4溶液
溶液褪色
SO2有氧化性
B
品红溶液
溶液褪色
SO2有漂白性
C
滴有酚酞的NaOH溶液
溶液褪色
SO2有漂白性
D
硫化氢水溶液
溶液变浑浊
SO2有还原性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列关于金属及其化合物的说法正确的是 ( )
A. Na2O为淡黄色固体,MgO为白色固体
B. 金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti
C. 铁放入浓硝酸中无明显现象,说明铁与浓硝酸不反应
D. 工业上常用电解熔融氯化镁的方法制取金属镁
难度: 中等查看答案及解析
-
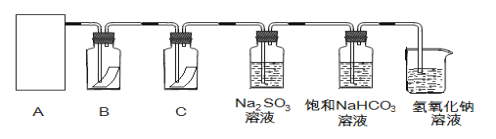
氯气是一种重要的工业原料。工业上利用反应2NH3+3Cl2===N2+6HCl检查氯气管道是否漏气。下列说法错误的是 ( )
A. 若管道漏气遇氨就会产生白烟
B. 该反应利用了Cl2的强氧化性
C. 该反应中氧化剂与还原剂的物质的量之比为2:3
D. 生成1molN2有6mol电子转移
难度: 中等查看答案及解析
-
用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
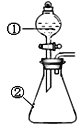
选项
①中物质
②中物质
预测②中的现象
A.
稀盐酸
碳酸钠与氢氧化钠的混合溶液
立即产生气泡
B.
浓硝酸
用砂纸打磨过的铝条
产生红棕色气体
C.
浓盐酸
二氧化锰
产生黄绿色气体
D.
新制氯水
淀粉—碘化钾溶液
溶液变蓝色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过下图实验处理,结果得到酸性溶液,还有少量气体剩余,则气体甲的组成可能为 ( )
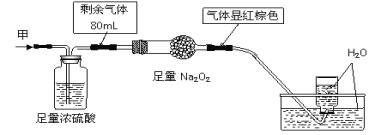
A. NH3、NO、CO2 B. NH3、NO2、N2 C. NH3、NO2、CO2 D. NO、CO2、N2
难度: 困难查看答案及解析
-
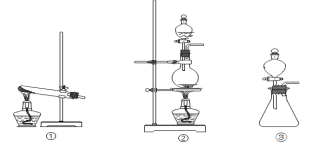
下列实验操作或装置正确的是( )
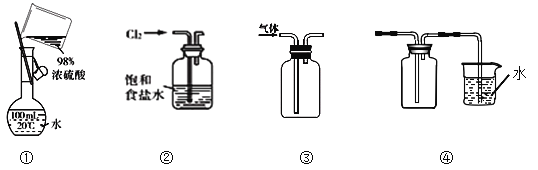
A. 图①表示为配制一定物质的量浓度稀硫酸时的操作
B. 用图②所示装置吸收氯气中的氯化氢气体
C. 用图③所示装置收集NO气体
D. 用图④所示装置吸收多余的NH3气,并防倒吸。
难度: 中等查看答案及解析
-
将一定物质的量的Na2CO3、NaHCO3组成的混合物溶于水,配成1L溶液,取出50mL溶液,然后滴加一定物质的量浓度的盐酸与它反应,得到的图象如下,下列说法正确的是

A. 标注 NaCl的直线代表产生的CO2的物质的量
B. 原混合物中Na2CO3与NaHCO3的物质的量之比为1:2
C. 盐酸的浓度是0.05 mol/L
D. 盐酸加到150mL时,放出CO2气体2.24L(标准状况下)
难度: 困难查看答案及解析
-
13.6g Fe和Fe2O3的混合物,加入150mL足量的稀硫酸,在标准状况下收集到1.12LH2,向反应后的溶液中滴加KSCN溶液不变红。为中和过量的H2SO4,并使Fe元素全部转化为Fe(OH)2沉淀,恰好消耗了200mL 3mol/L的NaOH溶液,则该稀H2SO4的物质的量浓度为( )
A. 2.25mol/L B. 2mol/L C. 3mol/L D. 0.6mol/L
难度: 困难查看答案及解析