-
用“空气吹出法”从海水中提取溴的工艺流程如下:
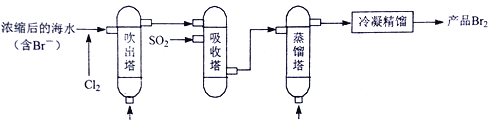
下列说法不正确的是
A. 蒸馏塔中只发生了物理变化
B. 吸收塔利用了SO2的还原性,使Br2还原成Br-
C. 在吸收塔中溴元素得到了富集
D. 吹出塔中通入水蒸气,能减小Br2的溶解度
难度: 中等查看答案及解析
-
有机物A的结构如右图所示,下列说法中正确的是
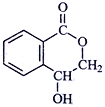
A. 有机物A易溶于水
B. 有机物A在铜的催化下与O2反应生成醛
C. 1molA最多能与4molH2发生加成反应
D. 在酸性条件下,有机物A水解形成一种有机物
难度: 中等查看答案及解析
-
下列有关实验结论正确的是
实验操作
实验现象
实验结论
A
向FeCl3和KSCN的混合溶液中加入KCl溶液
溶液红色变浅
增大生成物浓度,平衡向逆反应方向移动
B
某无色溶液中加入硝酸酸化,再加硝酸钡溶液
有白色沉淀
说明溶液中含有SO42-
C
饱和氯化银溶液与饱和碘化银溶液等体积混合
有黄色沉淀
Ksp(AgCl)>Ksp(AgI)
D
用洁净的铂丝蘸取少量溶液在酒精灯上灼烧
火焰呈紫色
该溶液一定是钾盐溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4LCH3COOH中含有碳原子数为2NA
B. 1.7g羟基(-OH)和1.7gOH-中含有质子数均为0.9NA
C. 1molN2与3molH2在一定条件下充分反应,生成NH3分子数目为2NA
D. 7.8gNa2O2与足量水反应,转移电子0.2NA
难度: 中等查看答案及解析
-
常温下,向20mL某一元酸(HA)溶液中逐滴加入0.1mol·L-1的NaOH溶液,测得混合溶液中由水电离出的c(H+)随加入NaOH溶液的体积变化关系图如下。下列说法不正确的是
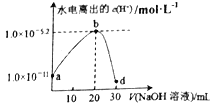
A. Ka(HA)的数量级为10-5
B. d点溶液的pH最大
C. b点溶液显酸性,c(A-)>c(Na+)>c(H+)>c(OH-)
D. d点溶液中,c(Na+)+c(H+)=c(A-)+c(OH-)
难度: 困难查看答案及解析
-
Q、W、X、Y、Z是原子序数依次增大的短周期元素。W、Y是金属元素,Z的原子序数是X的2倍。Q与W同主族,且Q与W形成的离子化合物中阴、阳离子电子层结构相同。Q与X形成的简单化合物的水溶液呈碱性。Y的氧化物既能与强酸溶液反应又与强碱溶液反应。下列说法不正确的是
A. Q与X形成简单化合物的分子为三角锥形
B. Z的氧化物是良好的半导体材料
C. 原子半径Y>Z>X>Q
D. W与X形成化合物的化学式为W3X
难度: 中等查看答案及解析
-
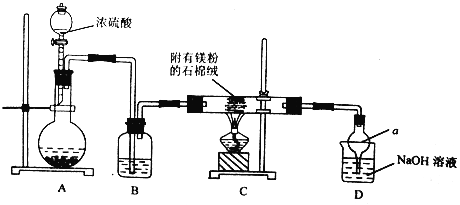
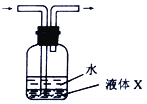
以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。下列说法正确的是
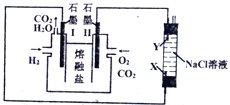
A. 石墨I电极反应为H2-2e-+2OH-=2H2O
B. CO2在石墨电极Ⅱ上得电子
C. X电极材料为铁
D. NaCl溶液中Cl-移向Y电极
难度: 困难查看答案及解析
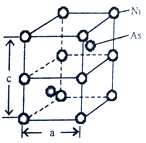
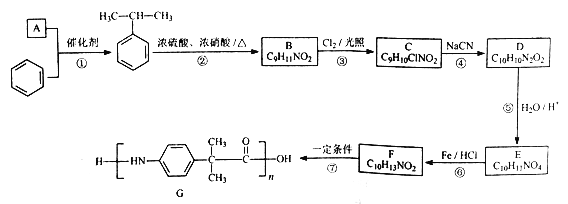
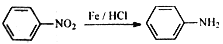
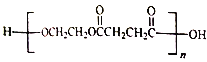 的合成路线___________(其它无机物任选)
的合成路线___________(其它无机物任选)