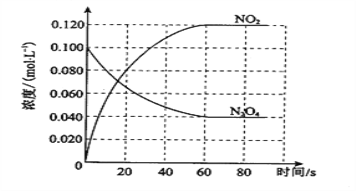
-
下列对盐类水解过程的说法正确的是( )
A.属于氧化还原反应
B.溶液的pH一定发生改变
C.水的电离程度增大
D.是放热的过程
难度: 简单查看答案及解析
-
已知:HCl为强酸,下列对比实验不能用于证明CH3COOH为弱酸的是
A. 对比等浓度的两种酸的pH
B. 对比等浓度的两种酸,与相同大小镁条反应的初始速率
C. 对比等浓度、等体积的两种酸,与足量Zn反应,生成H2的总体积
D. 对比等浓度、等体积的两种酸,与等量NaOH溶液反应后放出的热量
难度: 中等查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是
A. 强碱性溶液中:K+、Al3+、Cl-、SO42-
B. 室温下,pH=1的盐酸中:Na+、Fe2+、NO3-、SO42-
C. 含有Ca2+的溶液中:Na+、K+、CO32-、Cl-
D. 水电离产生的c(H+)=1×10-13 mol/L的溶液中:Na+、K+、Cl-、SO42-
难度: 中等查看答案及解析
-
下列热化学方程式中,△H能正确表示物质的燃烧热的是
A. CO(g) +1/2O2(g) ==CO2(g); △H=-283.0 kJ/mol
B. C(s) +1/2O2(g) ="=CO(g);" △H=-110.5 kJ/mol
C. H2(g) +1/2O2(g)==H2O(g); △H=-241.8 kJ/mol
D. 2C8H18(l) +25O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol
难度: 中等查看答案及解析
-
甲溶液的pH是4,乙溶液的PH是5,甲溶液与乙溶液的c(H+)之比为
A. 10:1 B. 1:10 C. 2:1 D. 1:2
难度: 中等查看答案及解析
-
MOH强碱溶液和等体积、等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是
A. c(M+)>c(OH-)>c(A-)>c(H+) B. c(M+)>c(A-)>c(H+)>c(OH-)
C. c(M+)>c(A-)>c(OH-)>c(H+) D. c(M+)>c(H+)>c(A-)>c(OH-)
难度: 困难查看答案及解析
-
要除去MgCl2 酸性溶液里少量的 FeCl3, 不宜选用的试剂是
A. MgO B. MgCO3 C. NaOH D. Mg(OH)2
难度: 中等查看答案及解析
-
下列性质中,能说明乙醇宜作燃料的是( )
①燃烧时发生氧化还原反应 ②充分燃烧的产物不污染环境
③乙醇是一种再生能源 ④燃烧时放出大量的热
A. ①②③④ B. ①②④ C. ①③④ D. ②③④
难度: 中等查看答案及解析
-
如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )
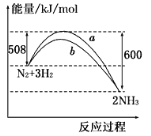
A. 该反应的热化学方程式为:N2+3H2
2NH3 △H=-92 kJ/mol
B. a曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,该化学反应的反应热不改变
D. 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为92kJ
难度: 中等查看答案及解析
-
下列各反应达到化学平衡,加压或降温都能使化学平衡向逆反应方向移动的是
A. 2NO2
N2O4(正反应为放热反应) B. C(s)+CO2
2CO(正反应为吸热反应)
C. N2+3H2
2NH3(正反应为放热反应) D. H2S
H2+S(s)(正反应为吸热反应)
难度: 简单查看答案及解析
-
反应A(g)+B(g)
2C(g)+3D(g)在四种不同情况下的反应速率如下,其中表示
反应速率最快的是
A. v(A)=0.20mol·L-1·min-1 B. v(B)=0.30 mol·L-1·min-1
C. v(C)=0.40 mol·L-1·min-1 D. v(D)=0.50 mol·L-1·min-1
难度: 简单查看答案及解析
-
下列说法可以证明反应N2(g)+3H2(g)
2NH3(g)已达到平衡状态的是
A. 1个N≡N键断裂的同时,有3个H—H键形成
B. 1个N≡N键断裂的同时,有3个H—H键断裂
C. N2、H2、NH3的分子数之比为1∶3∶2
D. 1个N≡N键断裂的同时,有6个H—N键形成
难度: 中等查看答案及解析
-
可逆反应mA(g)+nB(g)
pC(g)+qD(g),如右图所示是A的转化率同压强、温度的关系,分析图像结论正确是
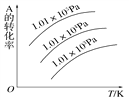
A. 正反应吸热,m+n>p+q B. 正反应吸热,m+n<p+q
C. 正反应放热,m+n > p+q D. 正反应放热,m+n < p+q
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 二氧化硫溶于水能导电,故二氧化硫属于电解质
B. 硫酸钡难溶于水,故硫酸钡属于弱电解质
C. 硫酸是强电解质,故纯硫酸能导电
D. 铜可以导电,但铜既不是电解质也不是非电解质
难度: 简单查看答案及解析
-
下列各反应中属于水解反应的是
A. HCO3-﹣+H2O
H3O++CO32- B. HCO3﹣-+H2O
H2CO3+OH-
C. HCO3-﹣+OH-﹣=H2O+CO32- D. HCO3-+H3O+=2H2O+CO2↑
难度: 中等查看答案及解析
-
对下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
A. 0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B. 0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C. 将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D. 在25℃0.1 mol/L的 NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)
难度: 困难查看答案及解析
-
常温下,以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是
A. 过滤后的溶液中一定没有S2-
B. MnS难溶于水,可溶于MnCl2溶液中
C. 常温时,CuS、PbS、CdS比MnS更难溶
D. 加入MnS后生成CuS的离子方程式是Cu2+ + S2-= CuS↓
难度: 中等查看答案及解析
-
用蒸馏水稀释1mol/L氨水至0.01mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A. c(OH-)/ c(NH3·H2O) B. c(NH4+)/ c(OH-) C. c(NH3·H2O)/ c(NH4+) D. c(OH-)
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A. 由H原子形成1molH-H键要吸收热量
B. 在稀溶液中,酸与碱中和生成水时释放的热量称为中和热
C. 氮气非常稳定,是因为氮气分子里含有氮氮三键,要破坏氮氮三键需吸收更多的能量
D. 凡经加热而发生的化学反应都是吸热反应
难度: 简单查看答案及解析
-
下列叙述正确的是
A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B.在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
C.常温下,1.0×10-3 mol·L-1盐酸的pH=3.0,1.0×10-8 mol·L-1盐酸的pH=8.0
D.常温下,若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
难度: 简单查看答案及解析