-
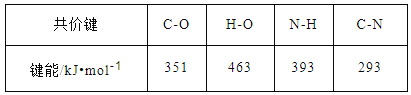
四种短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数2倍,Y、W同主族且能形成两种常见的化合物,Y、W质子数之和是Z质子数的2倍.则下列说法中正确的( )
A. X的氢化物的沸点可能高于Y的氢化物的沸点
B. 原子半径比较:X<Y<Z<W
C. X2H4与H2W都能使溴水褪色,且褪色原理相同
D. 短周期所有元素中,Z的最高价氧化物的水化物碱性最强
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 硝化甘油在体内能够分解出大量硝酸,会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛
B. 侯氏制碱法的工艺流程应用了物质溶解度的差异
C. 刚玉、红宝石、蓝宝石的主要成分是氧化铝,而青花瓷、分子筛的主要成分是硅酸盐
D. 生物炼铜法就是利用某种能耐受铜盐毒性的细菌,利用空气中的氧气把不溶性的硫化铜转化为可溶性的铜盐,从而使铜的冶炼变得成本低,污染小,反应条件十分简单
难度: 中等查看答案及解析
-
下列实验操作与实验目的或结论一致的是( )
选项
实验操作
实验目的或结论
A
取酸雨试样,加入10%H2O2溶液,再加入BaCl2溶液,有白色沉淀生成
该酸雨试样中一定含有H2SO4
B
将锌片和银片用导线连接后同时插入盛有稀硫酸的烧杯中,银片表面产生大量气泡
形成的原电池中锌作负极,银作正极
C
某无色溶液,加银氨溶液,水浴加热,有银镜生成
溶液中一定含有醛类化合物
D
配制FeCl2溶液时,先将FeCl2溶于适量稀硝酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的铁粉
抑制Fe 2+水解,并防止Fe 2+被氧化为Fe3+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列是三种有机物的结构简式,下列说法正确的是( )
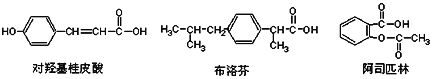
A. 三种有机物都能发生水解反应
B. 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C. 三种物质中,其中有两种互为同分异构体
D. 三种物质在一定条件下,均可以被氧化
难度: 中等查看答案及解析
-
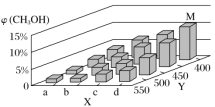
利用食盐水制取ClO2的工业流程如图所示,装置①中的反应:NaCl+3H2O
NaClO3+3H2↑,装置②中的反应:2NaClO3+4HCl
2ClO2+ Cl2↑+2NaCl+2H2O。下列关于该流程说法不正确的是( )
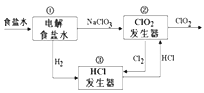
A. 该流程中Cl2、NaCl都可以循环利用
B. 装置①中H2是阴极产物
C. 装置②发生的反应中,Cl2是氧化产物,NaCl是还原产物
D. 为了使H2完全转化为HCl,需要向装置③中补充Cl2
难度: 中等查看答案及解析
-
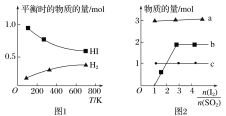
在湿法炼锌的电解循环溶液中,较高浓度的
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
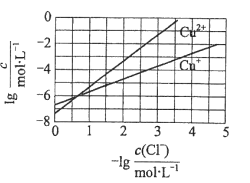
A.
的数量级为
B. 除
反应为Cu+Cu2++2
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
难度: 困难查看答案及解析
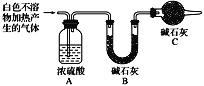
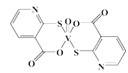
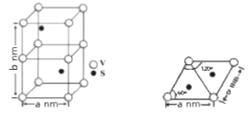
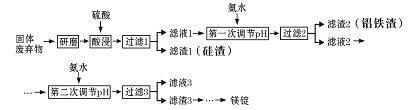
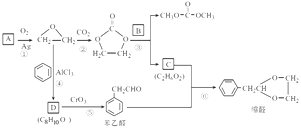
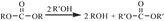 ②D为能与金属钠反应的芳香族化合物 回答下列问题:
②D为能与金属钠反应的芳香族化合物 回答下列问题: