-
下列关于反应速率的说法中,不正确的是
A. 反应速率用于衡量化学反应进行的快慢
B. 决定反应速率的主要因素有浓度、压强、温度和催化剂
C. 可逆反应达到化学平衡时,正、逆反应的速率都不为0
D. 增大反应物浓度、提高反应温度都能增大反应速率
难度: 简单查看答案及解析
-
2017年世界地球日我国的主题为“节约集约利用资源,倡导绿色简约生活”。下列做法应提倡的是( )
A. 夏天设定空调温度尽可能的低
B. 推广使用一次性塑料袋和纸巾
C. 少开私家车多乘公共交通工具
D. 对商品进行豪华包装促进销售
难度: 中等查看答案及解析
-
下列事实不能用原电池原理解释的是
A. 白铁(镀锌)制品比一般铁器耐腐蚀
B. 铁片、铝片在冷的浓硫酸中钝化
C. 电工操作规范中,不允许将铜线与铝线连接
D. 水库闸门、海轮船壳上装有一定数量的锌块
难度: 中等查看答案及解析
-
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反 应的活化能)。下列有关叙述正确的是
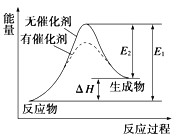
A. 该反应为放热反应
B. 逆反应的活化能大于正反应的活化能
C. 催化剂能改变该反应的焓变
D. 催化剂能降低该反应的活化能
难度: 简单查看答案及解析
-
实验室用4mol SO2与2molO2在一定条件下进行下列反应:2SO2(g)+O2(g)
2SO3(g); △H=-197kJ·mol-1,当放出 315.2kJ热量时,SO2转化率为
A. 40% B. 50% C. 80% D. 90%
难度: 简单查看答案及解析
-
电解精炼铜时,下列叙述不正确的是
A. 与电源正极相连的电极是粗铜板
B. 阴极发生反应:Cu2++ 2e-==Cu
C. 粗铜板上发生氧化反应
D. 电解池的阳极材料为纯铜薄片
难度: 简单查看答案及解析
-
关节炎首次发作一般在寒冷季节,原因是关节滑液中形成了尿酸钠晶体(NaUr),易诱发关节疼痛,其化学机理是:①HUr(aq)+H2O(1)
Ur-(aq)+H3O+(aq)
② Ur-(aq)+Na+(aq)
NaUr(s) △H
下列叙述错误的是
A. 降低温度,反应②平衡正向移动
B. 反应②正方向是吸热反应
C. 降低关节滑液中HUr及Na+含量是治疗方法之一
D. 关节保暖可以缓解疼痛,原理是平衡②逆向移动
难度: 中等查看答案及解析
-
对于反应2SO2(g)+O2(g)
2SO3(g),ΔH<0已达平衡,在其他条件不变的情况下,如果分别改变下列条件,对化学反应速率和化学平衡产生影响与图像不相符的是
A. 增加氧气浓度
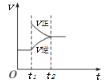 B. 增大压强
B. 增大压强 C. 升高温度
C. 升高温度 D. 加入催化剂
D. 加入催化剂
难度: 中等查看答案及解析
-
一定温度下,反应N2O4(g)
2NO2(g)的焓变为ΔH。现将1 mol N2O4充入一恒容密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
A.
 B.
B. C.
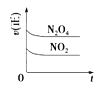 D.
D. 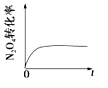
难度: 中等查看答案及解析
-
我国科研人员提出了由CO2 和 CH4 转化为高附加值产品CH3COOH 的催化反应历程如图所示:
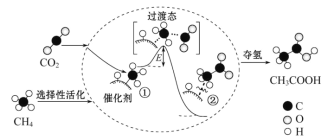
下列说法正确的是
A. 该反应证明任何非自发反应只要条件合适都能进行
B. 反应过程中,只有C—H 键发生断裂
C. 状态①、②之间的能量差即该反应的焓变
D. 合适的催化剂可有效降低活化能
难度: 中等查看答案及解析
-
常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)
Ni(CO)4(g) △H<0 230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍,
下列判断错误的是
A. 第一阶段,选择反应温度应髙于42.2℃
B. 第一阶段增加c(CO),平衡向正向移动,反应的平衡常数不变
C. 第二阶段,Ni(CO)4几乎完全分解
D. 第二阶段,及时分离出Ni,有利于平衡移动
难度: 中等查看答案及解析
-
臭氧是常见的强氧化剂,广泛用于水处理系统。制取臭氧的方法很多,其中高压放电法和电解纯水法原理如下图所示。下列有关说法错误的是

A. 两种方法都是电解原理
B. 高压放电出来的空气中,除含臭氧外还含有氮的氧化物
C. 电解纯水时,电极b发生的电极反应有3H2O-6e-=O3↑+6H+和2H2O-4e-=O2↑+4H+
D. 电解纯水时,H+由电极b经聚合固体电解质膜流向电极a
难度: 中等查看答案及解析
-
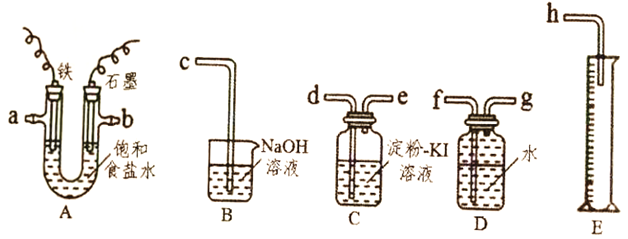
关于下列各装置图的叙述中,错误的是

A. 用装置①在铁上镀锌,则a为铁,b为锌
B. 装置②的总反应是:Fe+2Fe3+=3Fe2+
C. 装置③的反应实质是电解水
D. 装置④中开关由M改置于N时,Cu—Zn合金的腐蚀速率减小
难度: 中等查看答案及解析
-
气体的自动化检测中常应用根据原电池原理设计的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。

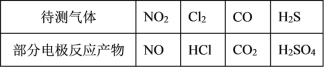
则下列说法中正确的是
A. 上述气体检测时,敏感电极均作电池负极
B. 检测 Cl2 气体时,敏感电极的电极反应式为 Cl2+2e-=2Cl-
C. 检测 H2S 气体时,对电极充入空气,对电极上的电极反应式为 O2+2H2O+4e-=4OH-
D. 检测 Cl2 和 CO 体积分数相同的两份空气样本时,传感器上电流大小、方向相同
难度: 中等查看答案及解析