-
下列各项表达中正确的是( )
A. Na2O2 的电子式为

B. 16O2 和 18O2 互为同素异形体
C. 在氮原子中,质子数为 7 而中子数不一定为 7
D. Cl—的结构示意图为
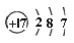
难度: 中等查看答案及解析
-
设 NA为阿伏加德罗常数的值,下列说法不正确的是( )
A. 0.012kg12C 中所含的碳原子数为阿伏加德罗常数
B. 标准状况下,22.4 L 的 CCl4 中含有的 CCl4 分子数为 NA
C. 常温常压下,18g H2O 含有的原子总数为 3NA
D. 1.00mol NaCl 中,所有 Na+的最外层电子总数为 8×6.02×1023
难度: 中等查看答案及解析
-
在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分。 当左边充入 28gN2,右边充入 8gCO 和 CO2 的混合气体时,隔板处于如图所示位置(两侧温度相同)。则混合气体中 CO 和 CO2 的分子个数比为( )
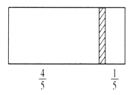
A. 1:1 B. 1:3 C. 2:1 D. 3:1
难度: 中等查看答案及解析
-
200 ml Fe2(SO4)3 溶液中含 Fe3+56g,溶液中 SO42-的物质的量浓度是( )
A. 5mol/L B. 7.5 mol/L C. 10 mol/L D. 2.5 mol/L
难度: 中等查看答案及解析
-
为了配制 100 mL 1 mol/L NaOH 溶液,其中有下列几种操作,错误的操作( )
①选刚用蒸馏水洗净过的 100 mL 容量瓶进行配制
②NaOH 固体在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中
③用蒸馏水洗涤烧杯内壁两次,洗涤液都移入容量瓶中
④使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹液面恰好跟刻度相切
⑤由于不慎,液面超过了容量瓶的刻度线,这时采取的措施是使用胶头滴管吸出超过的一部分
A. ②④⑤ B. ①⑤ C. ②③⑤ D. ①②
难度: 中等查看答案及解析
-
下列有关物质分类或归类正确的一组是( )
① 酸性氧化物 SO2、NO、CO2、SiO2
②铝热剂、盐酸、水玻璃、氨水均为混合物
③明矾、小苏打、次氯酸均为电解质
④碘酒、 牛奶、豆浆、漂白粉均为胶体
⑤液氨、液氯、干冰、碘化银均为化合物
A. ①③ B. ②③ C. ③④ D. ②⑤
难度: 中等查看答案及解析
-
下列解释与胶体无关的是( )
A. 在饱和氯化铁溶液中逐滴加入烧碱溶液,产生红褐色沉淀
B. 豆制品厂用石膏或盐卤点制豆腐
C. 水泥厂用先进的电除尘技术除去空气中的粉尘
D. 洪灾发生地的农民用明矾净化河水作为生活用水
难度: 简单查看答案及解析
-
下列中的诗句内容基本不涉及化学变化的是( )
A. 王安石的《元日》: “爆竹声中一岁除,春风送暖入屠苏”
B. 刘禹锡的《浪淘沙》: “美人首饰侯王印,尽是江中浪底来”
C. 刘琨的《重赠卢谌》: “ 何意百炼钢,化为绕指柔”
D. 李商隐的《无题》: “春蚕到死丝方尽,蜡炬成灰泪始干”
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A. 浓盐酸与铁屑反应: 2Fe+6H+=2Fe3++3H2↑
B. 钠与 CuSO4 溶液反应: 2Na+Cu2+=Cu↓+2Na+
C. NaHCO3 溶液与稀 H2SO4 反应:CO32-+2H+=H2O+CO2↑
D. 向 Ba(OH)2 溶液中滴加NaHSO4溶液至中性:Ba2++2OH—+2H++SO42-=BaSO4↓+2H2O
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 1.0 mol•L﹣1KNO3 溶液: H+、 Fe2+、 Cl﹣、 SO42﹣
B. 能溶解 Al2O3 的溶液: Na+、 K+、 Cl﹣、 SiO32﹣
C. 无色透明溶液中: Al3+、 Cu2+、 Cl﹣、 HCO3﹣
D. 使甲基橙变红色的溶液: Mg2+、 K+、 Cl﹣、 SO42﹣
难度: 中等查看答案及解析
-
可以用离子方程式 2H++CO32﹣=H2O+CO2↑来表示的化学反应是( )
A. 硝酸和碳酸氢钠溶液的反应 B. 稀硫酸和碳酸钾溶液的反应
C. 醋酸和碳酸钠溶液的反应 D. 盐酸和碳酸钡溶液的反应
难度: 中等查看答案及解析
-
对于某些离子的检验及结论一定正确的是( )
A. 加入稀盐酸产生无色无味并能使澄清石灰水变浑浊的气体,一定有 CO32﹣
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有 SO42﹣
C. 加入硝酸无明显现象,再滴几滴硝酸银溶液有白色沉淀,一定有 Cl﹣
D. 加入新制氯水后,再滴几滴 KSCN 溶液,变红,一定有 Fe2+
难度: 中等查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应NaN3+KNO3―→K2O+Na2O+N2↑。对上述反应的描述错误的是( )
A. NaN3是还原剂,KNO3是氧化剂
B. 该反应中有两种元素的化合价发生变化
C. 配平后物质的系数依次为 10、2、1、5、16
D. 若生成 8 mol N2,则转移电子的物质的量为 5 mol
难度: 中等查看答案及解析
-
某溶液含以下离子 Na+、 K+、 Al3+、 Ba2+、 SO42-、 I-、 CO32-中的一种或几种, 除水电离产生的 H+和 OH-外不再含其它离子,为确定其成份,进行了如下实验,分别取样:①用 pH 计测试,溶液显弱酸性②加氯水和淀粉无明显现象③用铂丝蘸取溶液在酒精灯上灼烧可观察到黄色火焰。为确定该溶液的组成,还需检验的离子是( )
A. K+ B. SO42- C. Ba2+ D. Al3+
难度: 中等查看答案及解析
-
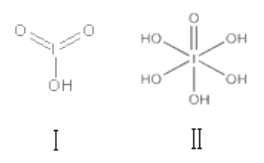
下列说法中正确的是( )
A. Na2S2、 NaClO 中所含化学键类型完全相同
B. 只有活泼金属元素与活泼非金属元素之间才能形成离子键
C. 等物质的量的 CN-和 N2 含有的共用电子对数相等
D. 氯气与 NaOH 反应的过程中,同时有离子键、极性键和非极性键的断裂和形成
难度: 中等查看答案及解析
-
X、Y、W、Z 是四种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知 W 的一种核素的质量数为 18,中子数为 10,X和Ne原子的核外电子总数相差 1;Y 的单质是一种常见的半导体材料; Z 的非金属性在同周期主族元素中最强。 下列说法正确的是( )

A. 最高化合价: X>Y>Z>W
B. 简单气态氢化物的稳定性: Z>Y>W
C. Y 的氧化物与 X、 Z 的最高价氧化物对应的水化物均能反应
D. 由 X、 Z、 W 三种元素形成的化合物一定既含有离子键又含共价键
难度: 简单查看答案及解析
-
某离子反应涉及 H2O、 ClO﹣、 NH4+、 H+、 N2、 Cl﹣六种微粒.其中 c(NH4+)随反应进行逐渐减小。 下列判断正确的是( )
A. 反应的还原产物是 N2
B. 消耗 1 mol 氧化剂,转移电子 3 mol
C. 氧化剂与还原剂的物质的量之比为 2: 3
D. 反应后溶液的酸性明显增强
难度: 中等查看答案及解析
-
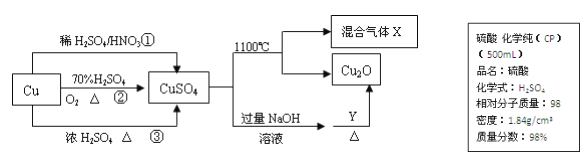
反应(1)、 (2)分别是从海藻灰和智利硝石中提取碘的主要反应:
2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2 (1)
2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2 (2)
下列说法正确的是( )
A. 两个反应中 NaHSO4 均为氧化产物
B. I2 在反应(1)中是还原产物,在反应(2)中是氧化产物
C. 氧化性: MnO2>SO42- >IO3->I2
D. 反应(1)、 (2)中生成等量的 I2 时转移电子数之比为 1:5
难度: 中等查看答案及解析
-
向含 Na+、 Al3+、 Fe3+、 Fe2+、 Cl﹣、 SO42﹣的水溶液中,加入足量的 Na2O2 固体,充分反应后再加入过量的稀盐酸,所得溶液与起始溶液相比,上述离子数目没有变化的有( )
A. 2 种 B. 3 种 C. 4 种 D. 5 种
难度: 困难查看答案及解析
-
设 NA为阿伏加德罗常数的值,下列说法不正确的是( )
A. 4.6g 金属钠与足量 O2 充分反应后,所得固体中阴、阳离子的总数为 0.3NA
B. 在反应 KClO3+6HCl=KCl+3Cl2↑+3H2O中,当得到标准状况下67.2LCl2时,反应中转移的电子数为6NA
C. 2.0g H218O 与 D2O 的混合物中所含中子数为NA
D. 1L 含NA个Al3+的 Al(NO3)3 液中, NO3—物质的量浓度大于 3 mol/L
难度: 中等查看答案及解析
-
某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣ 中的若干种离子,离子浓度均为 0.1mol•L﹣1.某同学进行了如下实验:
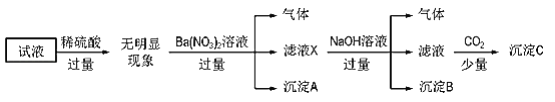
下列说法正确的是( )
A. 无法确定原试液中是否含有 Al3+、 Cl﹣
B. 滤液 X 中大量存在的阳离子有 NH4+、 Fe2+和 Ba2+
C. 无法确定沉淀 C 的成分
D. 原溶液中存在的离子为 NH4+、 Fe2+、 Cl﹣、 SO42﹣
难度: 困难查看答案及解析