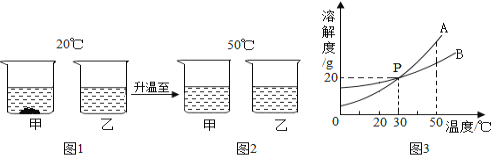
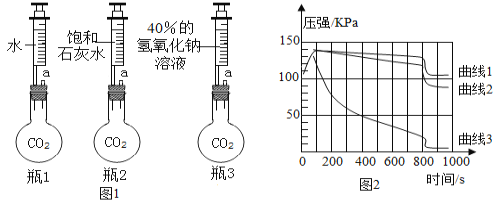
-
空气是生命赖以生存的物质,空气中含量最多的气体是
A. 氮气 B. 氧气 C. 二氧化碳 D. 稀有气体
难度: 简单查看答案及解析
-
下列工艺制作过程包含化学变化的是( )
A. 烧制陶瓷 B. 裁剪窗花 C. 雕刻玉石 D. 编织竹篮
难度: 简单查看答案及解析
-
餐桌上的饮品种类丰富,下列饮品中属于溶液的是
A.酸奶 B.玉米糊 C.雪碧 D.冰水
难度: 简单查看答案及解析
-
通过一学期的学习,同学们对“化学”有一定的认识,下列关于“化学”的认识,错误的是
A.化学能创造新的物质 B.化学可以保护环境
C.化学能帮助人们改善生活 D.化学只会破坏自然
难度: 简单查看答案及解析
-
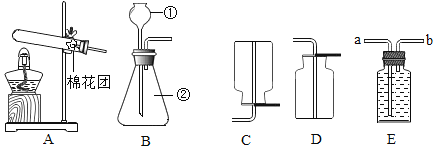
下列实验操作错误的是
A.
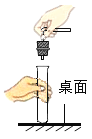 B.
B.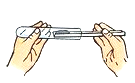 C.
C.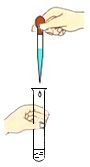 D.
D.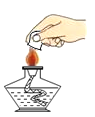
难度: 简单查看答案及解析
-
下列说法中,正确的是
A.可用燃着的木条鉴別氧气和二氧化碳
B.空气中氧气质量占空气质量的21%
C.在化学变化中,分子可以被消灭但不能被创造
D.加热碳酸氢铵时,白色固体消失,说明该变化不符合质量守恒定律
难度: 简单查看答案及解析
-
物质的性质决定用途,下列物质的用途中,利用化学性质的是
A.金刚石刻划玻璃 B.活性炭吸附异味
C.干冰人工降雨 D.锌与稀盐酸制氢气
难度: 简单查看答案及解析
-
下列物质溶于水时,溶液温度明显降低的是
A.氯化钠 B.硝酸铵 C.蔗糖 D.氢氧化钠
难度: 简单查看答案及解析
-
次氯酸(HC1O)是一种强氧化性物质,可以用来消毒杀菌,下列有关次氯酸的说法正确的是
A.属于氧化物 B.氢、氯、氧三种元素质量比是1:35.5:16
C.氯元素化合价为-1 D.是由四种元素组成的物质
难度: 中等查看答案及解析
-
研究和学习化学,有许多方法。下列叙述中,错误的是
A.转化法:碳酸钙在一定条件下能生成CO2,推测CO2也能转化为碳酸钙
B.实验法:用红磷燃烧做“测定空气中氧气含量”的实验
C.类比法:铜在空气中灼烧与氧气反应,推测金在空气中灼烧也能与氧气反应
D.分类法:根据组成物质的元素,可将纯净物分为单质和化合物
难度: 中等查看答案及解析
-
下列说法错误的是
A.春天闻到花香味,说明分子在不断运动
B.当水结成冰时,体积膨胀,说明冰分子比水分子大
C.N2化学性质不活泼,而O2化学性质活泼,说明不同分子化学性质不同
D.含有一种元素的物质可能是混合物
难度: 简单查看答案及解析
-
如图中两圆相交部分表示相邻两种物质反应的现象。下列描述错误的是
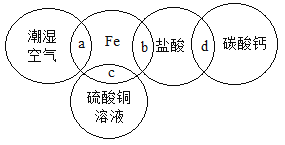
A.a处无明显现象
B.b处形成浅绿色溶液
C.c处有红色物质析出
D.d处有气泡产生
难度: 中等查看答案及解析
-
用“捕捉”的CO2生产甲醇,反应的微观示意图如图2所示:
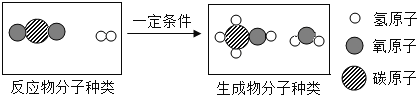
下列说法中,正确的是
A.甲醇中氢的质量分数最大 B.该反应的化学方程式:CO2+H2
CH4O+H2O
C.反应前分子种类有两种 D.反应前后原子的数目发生了变化
难度: 中等查看答案及解析
-
超细的铁粉是一种钠米颗粒型材料,可在低温下将CO2转化为炭,下列推测错误的是
A.该反应有助于减少温室气体排放 B.超细铁粉在反应中可能起催化作用
C.该反应的另一产物可能是O2 D.该反应属于化合反应
难度: 中等查看答案及解析
-
道尔顿、汤姆生和卢瑟福等科学家对原子结构进行了不断探索
下列叙述正确的是
原子由原子核和核外电子构成
原子的质量主要集中在原子核上
原子核在原子中所占的体积极小.
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列除去物质中少量杂质的方法错误的是
选项
物质
杂质
除杂方法
A
N2
O2
将混合气体缓慢通过灼热的铜网
B
NaCl
泥沙
加水溶解、过滤、蒸发
C
KCl
KClO3
加入少量MnO2,加热
D
铜粉
铁粉
加入足量的稀盐酸,过滤、洗涤、干燥
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
硅(Si)是半导体材料,利用石英砂(主要成分是SiO2)制取高纯度Si,其发生的主要反应如下:反应①SiO2+2C
Si(粗硅)+2CO;反应②Si(粗硅)+Cl2+HCl
SiHCl3(纯);反应③:SiHCl3(纯)+H2
Si(纯)+3HCl
下列说法正确的是
A.反应①、②、③均为置换反应 B.反应①产生的尾气可直接排放
C.地壳中硅元素含量最高 D.反应中的HC1可循环使用
难度: 中等查看答案及解析
-
已知:白磷的着火点为40℃,红磷的着火点为240℃,据下图所示的实验现象,下列判断正确的是
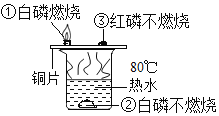
甲.①②说明物质燃烧需要氧气
乙.实验中使用了铜片,主要是利用铜的导热性
丙.烧杯中的热水只起提高温度的作用
丁.①说明燃烧需要可燃物
A.甲和乙 B.甲和丙
C.乙和丁 D.丙和丁
难度: 中等查看答案及解析
-
下列图象能正确反映对应变化关系的是
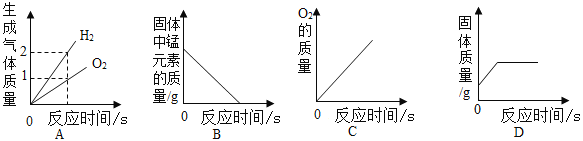
A.电解水时产生H2、O2的质量 B.加热一定量的KMnO4固体
C.向一定量的H2O2溶液中加入少量MnO2 D.向盛有铁钉的烧杯中加入一定质量的CuSO4溶液
难度: 困难查看答案及解析
-
以300g30.4%的FeSO4溶液为原料制铁黑画料Fe3O4(其中Fe既有+2价,也有+3价)的过程如下:
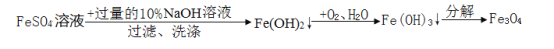
已知:FeSO4+2NaOH=Fe(OH)2 ↓+Na2SO4;4Fe(OH)2+O2+H2O=4Fe(OH)3
下列说法中,正确的是
A.制备的过程中只有Fe的化合价发生变化
B.洗涤的目的仅仅是为了除去生成的Na2SO4
C.理论上Fe(OH)2转化为Fe(OH)3的过程中参与反应的O2的质量为3.2g
D.该方法理论上最终可以获得Fe3O4的质量为46.4g
难度: 困难查看答案及解析