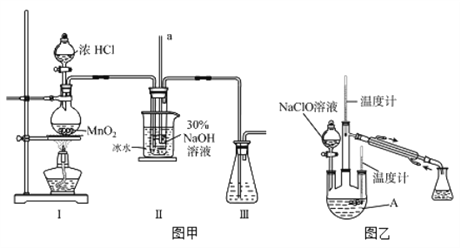
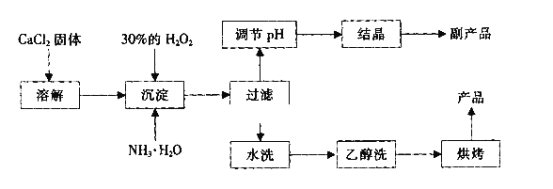
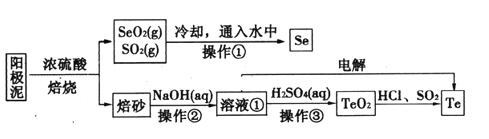
-
化学与生产和生活密切相关,下列有关说法正确的是
A. 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰
B. 英文的“中国”一词又指“瓷器”,中国瓷器驰名世界,其主要成分是SiO2
C. 泡沫灭火器中用的是小苏打和硫酸铝
D. 二氧化硫有毒,严禁将其添加到任何食品和饮料中
难度: 中等查看答案及解析
-
如果化学老师家里的食用花生油不小心混入了大量的水,利用你所学的知识助老师-臂之力,采用最简便的分离方法是( )
A.
 B.
B. 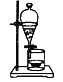 C.
C. 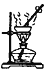 D.
D. 
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 密闭容器中2 mol NO与1 mol O2充分反应,产物分子的数目为2NA
B. 25℃,pH=13的NaOH溶液中含有OH-的数目为 0.1NA
C. 标准状况下,22.4LN2与CO混合气体的质量为28g
D. 标准状况下,22.4 L CCl4含CCl4分子数为NA
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. 含有大量Al3+的溶液中:K+、Mg2+、NO3-、HCO3-
B. 与铝粉反应放出氢气的无色溶液中:NO3﹣、Mg2+、Na+、SO42﹣
C. 常温下由水电离出的c(H+)=10-13 mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-
D. Kw/c(H+) =10-13 mol·L-1溶液中:Fe3+、NH4+、Mg2+、SO42-
难度: 中等查看答案及解析
-
“纳米材料”是粒子直径为l~100 nm(纳米)的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀
A. ②③④ B. ①④⑥ C. ②③⑤ D. ①③④⑥
难度: 简单查看答案及解析
-
运动会上使用的发令枪所用的“火药”主要成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学反应方程式为:5KClO3+6P=3P2O5+5KCl,则下列有关叙述正确的是
A. 上述反应中氧化剂和还原剂的物质的量之比为6∶5
B. 上述反应中消耗3molP时,转移电子的物质的量为15mol
C. KCl既是氧化产物,又是还原产物
D. 因红磷和白磷互为同素异形体,上述火药中的红磷可以用白磷代替
难度: 中等查看答案及解析
-
利用如图所示装置进行下列实验,能得出相应实验结论是( )
选项
①
②
③
实验结论

A
稀硫酸
Na2S
CuSO4溶液
H2S酸性强于H2SO4
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀盐酸
亚硫酸钠
硝酸钡溶液
二氧化硫与可溶性钡盐均可生成白色沉淀
D
浓硝酸
碳酸钠
硅酸钠溶液
酸性:硝酸>碳酸>硅酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A. FeCl3腐蚀电路板:Fe3++Cu=Fe2++Cu2+
B. NaHCO3溶液与NaOH溶液反应:H++OH-=H2O
C. 氨水和醋酸溶液混合:NH3·H2O+CH3COOH=NH4++CH3COO-+H2O
D. 向AlCl3溶液中加入过量的氨水:A13++4NH3·H2O=AlO2-+2H2O+4NH4+
难度: 中等查看答案及解析
-
有关氧化还原反应的理解正确的是
A. (NH4)2SO4在高温下分解生成 SO2、H2O、N2和 NH3。则该反应的氧化产物与还原产物的物质的量比为1:3
B. 已知反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为12 mol
C. 一定条件下,氯酸钾与碘发生反应2KClO3+I2=2KIO3+Cl2,由此判断氧化性:I2>Cl2
D. 在反应CH3CH2OH+K2Cr2O7(H+)→CH3COOH中,每消耗1mol乙醇转移3NA个电子(NA为阿伏伽德罗常数的值)
难度: 中等查看答案及解析
-
自然界的硫循环如下图所示,下列说法不正确的是
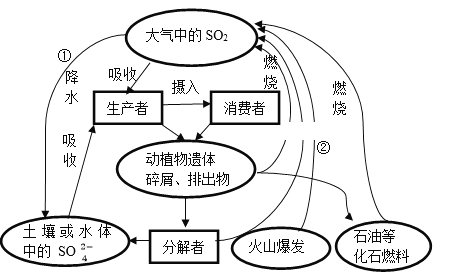
A. ①和②中硫元素均被氧化
B. 控制化石燃料的使用可以减少SO2排放
C. 含硫有机物和含硫无机物可相互转化
D. ①是自然界形成酸雨的唯一原因
难度: 中等查看答案及解析
-
下列叙述中不正确的是
A. 元素在周期表中的位置,反映了元素的原子结构和元素的性质
B. 硫酸的酸性比次氯酸的酸性强,所以硫的非金属性比氯强
C. 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
D. 人们在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料
难度: 简单查看答案及解析
-
下列有关硅及其化合物的描述中,不正确的是
A. SiO2可用于制造光导纤维
B. 盛装NaOH溶液的试剂瓶不用玻璃塞的原因是因为玻璃塞与NaOH溶液反应
C. 普通玻璃是以纯碱、石灰石和石英为原料制成的
D. H2SiO3可以用二氧化硅和水反应制得
难度: 中等查看答案及解析
-
已知某化学反应A2(g)+2B2(g)═2AB2(g)(A2、B2、AB2的结构式分别为 A═A、B﹣B、B﹣A﹣B),能量变化如图所示,下列有关叙述中正确的是

A. 该反应的进行一定需要加热或点燃条件
B. 该反应若生成2molAB2(g)则放出的热量为(E1﹣E2)kJ
C. 该反应断开化学键消耗的总能量大于形成化学键释放的总能量
D. 生成2 molB﹣A键放出E2 kJ能量
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W、Q原子序数依次增大,其中X是组成有机物的必要元素,元素Y的原子最外层电子数是其电子层数的3倍,元素W与X同主族,Z与Q最外层电子数相差6。下列说法正确的是
A. Y与Z可形成含共价键的离子化合物
B. Y的简单气态氢化物的热稳定性比X的强,是因为Y的简单气态氢化物分子间有氢键
C. 原子半径:r(Q)>r(W)>r(X)>r(Y)
D. 元素Y、Z、Q组成的化合物水溶液一定呈碱性
难度: 中等查看答案及解析
-
将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s) + 2Cl2(g) == TiCl4(l) + O2(g) △H = +140.5 kJ/mol
C(s,石墨) + 1/2O2(g) == CO(g) △H = -110.5 kJ/mol
则反应TiO2(s) + 2Cl2(g) + 2C(s,石墨) == TiCl4(l) + 2CO(g) 的△H 是
A. +80.5 kJ/mol B. +30.0 kJ/mol C. -30.0 kJ/mol D. -80.5 kJ/mol
难度: 中等查看答案及解析
-
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理下图所示,下列说法正确的是
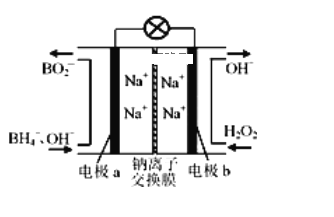
A. 电池放电时Na+从b极区移向a极区
B. 电极a采用MnO2,放电时它被还原
C. 该电池负极的电极反应式为:BH4-+8OH-—8e-═BO2-+6H2O
D. 放电时,a极区的电极反应生成碱,碱性增强
难度: 中等查看答案及解析