-
化学与生活密切相关。下列说法正确的是
A. 丝绸的主要成分是蛋白质 B. 电器起火应选用泡沫灭火剂灭火
C. 光导纤维的成分是晶体硅 D. 生活用水的净化与消毒可用明矾
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 5.6g铁与稀硝酸反应,转移电子数一定为0.3NA
B. 密闭容器中,1molN2和3molH2催化反应后分子总数大于2NA
C. 3.2gN2H4中含有共用电子对的总数为0.6NA
D. 室温下,pH=1的H3PO4溶液中,含有0.1NA个H+
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是
A. 丙烷的二氯取代物有2种
B. 乙烯和聚乙烯中碳原子的成键方式完全相同
C. 可用饱和碳酸钠溶液除去乙酸乙酯中的乙酸
D. 饱和硫酸铵溶液和福尔马林都可使鸡蛋清溶液发生变性
难度: 中等查看答案及解析
-
已知:NH3+CO2+H2O+NaCl= NaHCO3↓+NH4Cl。若实验室根据此原理制备少量的NaHCO3,下列实验过程中选用的主要仪器不正确的是
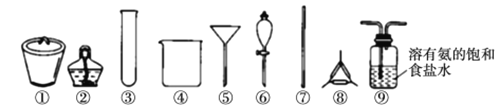
A. 制取氨气,可选用②③ B. 制取 NaHCO3,可选用⑨
C. 分离 NaHCO3,可选用④⑤⑦ D. 干燥 NaHCO3,可选用①②⑦⑧
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,且X、Z是同族元素,W元素的单质为淡黄色固体。它们的最高价氧化物溶于水可得四种溶液,0.010mol·L-1的这四种溶液pH与该元素原子半径的关系如右图所示。下列说法正确的是
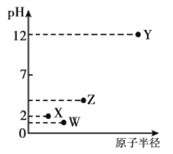
A. W的氧化物的水化物一定是强酸
B. 气态氢化物的稳定性:Z>X
C. 简单离子半径:W>Y
D. Y与W形成的化合物一定含有共价键
难度: 中等查看答案及解析
-
室温下, NaHSO3溶液显酸性,溶液中部分离子浓度随 NaHSO3浓度的变化情况如下图所示。下列关系式一定正确的是
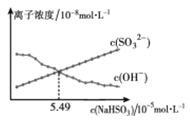
A. c( Na+)+c(H+')=c( SO32-)+c(OH-)+c( HSO3- )
B. c( Na+)=c( HSO3-)+c(SO32-)+c(H2SO3)
C. c( Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
D. c(HSO3-)=5.49mol·L-1时,c(SO32-)=c(OH-)
难度: 困难查看答案及解析
-
如图所示,实验开始时先闭合K1,断开K2。一段时间后,再断开K1,闭合K2,电流表指针偏转,同时A极质量减轻。下列说法不正确的是
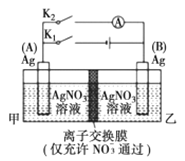
A. 闭合K1,断开K2后,B极:Ag-e-=Ag+
B. 闭合K1,断开K2后,乙池溶液浓度上升
C. 断开K1,闭合K2后,A电极发生氧化反应
D. 断开K1,闭合K2后,NO3-从甲池进入乙池
难度: 困难查看答案及解析
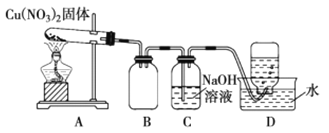
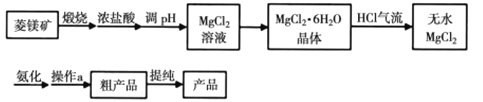
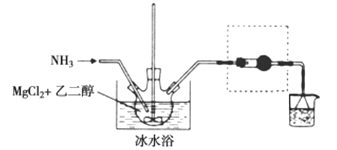
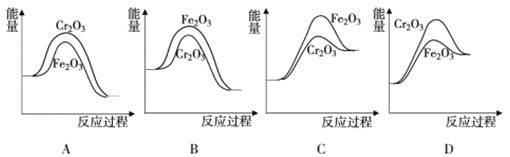
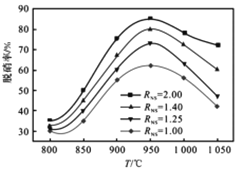
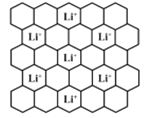
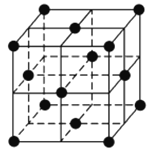

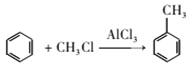 ,结合上述流程信息,设计由苯为主要原料合成对甲基苯酚的路线(无机试剂任选)______________________。
,结合上述流程信息,设计由苯为主要原料合成对甲基苯酚的路线(无机试剂任选)______________________。