-
从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一种工艺流程如图:(已知TeO2微溶于水,易溶于强酸和强碱) 下列有关说法正确的是
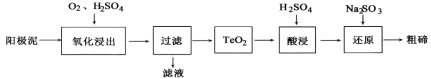
A. “氧化浸出”时为使碲元素沉淀充分,应加入过量的硫酸
B. “过滤”用到的玻璃仪器:分液漏斗、烧杯、玻璃棒
C. “还原”时发生的离子方程式为2SO32-+Te4++4OH-=Te↓+2SO42-+2H2O
D. 判断粗碲洗净的方法:取少量最后一次洗涤液,加入BaCl2溶液,没有白色沉淀生成
难度: 中等查看答案及解析
-
下列说法正确的是
A. 高级脂肪酸乙酯是生物柴油中的一种成分,它属于油脂
B. 天然纤维、聚酯纤维、光导纤维都属于有机高分子材料
C. 离子交换膜在工业上应用广泛,如在氯碱工业中使用的阴离子交换膜
D. 国产大客机C919大规模使用先进的材料铝锂合金,该合金密度小,强度高
难度: 中等查看答案及解析
-
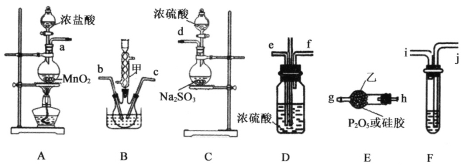
下列实验操作及现象和结论均正确的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
NA是阿伏加德罗常数的值。下列说法正确的是
A. Fe与稀硝酸反应,产生标准状况下3.36L的NO气体,则参加反应的硝酸为0.6NA
B. 常温下,1L 0.5mol·L-1的Na2CO3溶液与1 L0.5mol·L-1的Na2S溶液中阳离子数均为NA
C. 1.0 mol CH4与足量的C12在光照下反应生成的CH3C1分子数为1.0 NA
D. 1mol N2与足量H2在一定条件下充分反应生成1.12LNH3,转移的电子数为0.15NA
难度: 中等查看答案及解析
-
1,1-二环丙基乙烯(
)是重要医药中间体,下列关于该化合物的说法错误的是
A. 所有碳原子可能在同一平面 B. 能使酸性高锰酸钾溶液褪色
C. 二氯代物有9种 D. 生成1mol C8H18至少需要3mol H2
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、M的原子序数依次增大,其中X、Y、Z三种元素中,可形成含二种元素的10电子微粒m、n、p、q,且有反应m+n
p↑+q;M的最高价氧化物对应的水化物为最强酸。则下列说法不正确是
A. 简单离子半径X<Z<Y<M
B. 由X、Y、Z三种元素组成的化合物可以是离子化合物
C. X、Y、Z三种元素组成的化合物的水溶液一定呈酸性
D. MZ2可用于自来水的杀菌消毒
难度: 中等查看答案及解析
-
双极膜电渗析一步法盐制酸碱的技术进入到了工业化阶段,某科研小组研究采用BMED膜堆(如图所示),模拟以精制浓海水为原料直接制备酸和碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜(a、d)已知:在直流电源的作用下,双极膜内中间界面层发生水的解离,生成H+和OH-。下列说法正确的是
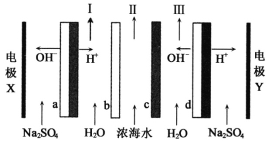
A. 电极Y连接电源的正极,发生还原反应
B. I口排出的是混合碱,Ⅱ口排出的是淡水
C. 电解质溶液采用Na2SO4溶液可避免有害气体的产生
D. a左侧膜为阳离子交换膜,c为阴离子交换膜
难度: 中等查看答案及解析
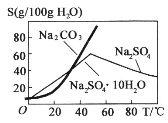

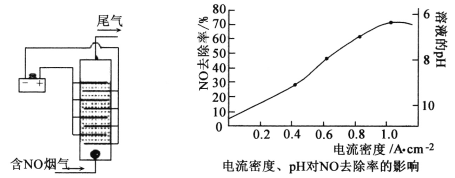

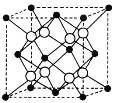
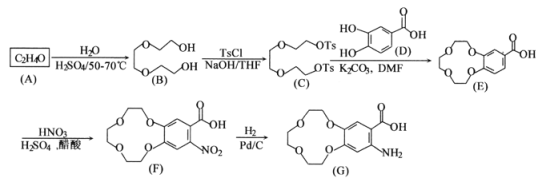
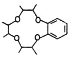 合成路线。_____________________________________
合成路线。_____________________________________