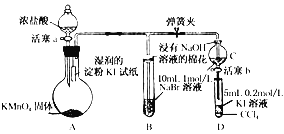
-
下列正确的组合是
①砷(As)位于元素周期表第ⅤA族,其最高价氧化物对应水化物的酸性比硝酸弱
②铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
③气态氢化物的水溶液的酸性H2S弱于HCl
④非金属元素的气态氢化物溶于水后,均形成无氧酸
A. ①③④ B. ①②④ C. ①③ D. ②③
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物。常温下,Z的单质能溶于X的最高价氧化物水化物的稀溶液,不溶于其浓溶液。下列说法正确的是
A. Z位于第三周期、IIIA族 B. 元素Y的正化合价最高为+6
C. 简单离子半径的大小顺序:X<Y<Z D. X和Y只能形成两种化合物
难度: 中等查看答案及解析
-
下列关于化学观或化学研究方法的叙述中,错误的是
A. 在化工生产中应遵循“绿色化学”的思想
B. 在过渡元素中寻找优良的催化剂
C. 在元素周期表的金属和非金属分界线附近寻找半导体材料
D. 根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4
难度: 中等查看答案及解析
-
下列化学用语表示正确的是
A. HClO的结构式:H-Cl-O
B. 硫原子的原子结构示意图:
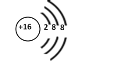
C. 过氧化钠的电子式为:Na+[ :O:: O: ]2-Na+
D. R2+离子核外有a个电子,b个中子,R原子表示为:
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 元素周期表中元素排序的依据是元素的相对原子质量
B. 元素周期表中元素排序的依据是原子的质量数
C. 元素周期表有十六个纵行,也就是十六个族
D. 在元素周期表中,从ⅢB族到ⅡB族的10个纵列中,所有的元素都是金属元素
难度: 简单查看答案及解析
-
下列分子中所有原子均满足最外层8电子结构的是
A. LiCl B. NCl3 C. PCl5 D. BF3
难度: 中等查看答案及解析
-
N的质量数为14,在粒子NH3T+中,电子数、质子数、中子数之比为
A. 10∶7∶11 B. 10∶11∶8 C. 10∶11∶9 D. 11∶9∶10
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是
A. 在标准状况下,1mol任何气体单质均含有2NA个原子
B. 1molCH3+(碳正离子)中含电子数目为10NA
C. 常温下,在18g
中含有
个氧原子
D. 在标准状况下,22.4L甲烷和22.4L H2O中含电子数均为10NA
难度: 简单查看答案及解析
-
四种主族元素的离子aXm+、bYn+、cZn-和dRm-,它们具有相同的电子层结构,若m>n,则下列叙述正确的是
①a-b=n-m ②元素的原子序数:a>b>c>d
③元素非金属性:Z>R ④最高价氧化物对应的水化物的碱性:X>Y
A. 只有③ B. ①②③④ C. ①②③ D. ②③
难度: 简单查看答案及解析
-
下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是
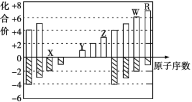
A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1:1和1:2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
下列说法不正确的是( )
①质子数相同的粒子一定是同种元素
②同位素的性质几乎相同
③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子
④电子数相同的粒子不一定是同一种元素
⑤一种元素只能有一种质量数
⑥某种元素的相对原子质量取整数,就是其质量数
A. ②③⑤⑥ B. ①②④⑤ C. ①②⑤⑥ D. ③④⑤⑥
难度: 中等查看答案及解析
-
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在a g HmX中所含质子的物质的量是
A.
B.
C.
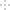
D.
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
下列叙述正确的是
A. X、Y元素的金属性:X<Y
B. 一定条件下,W单质可以将Z单质从其氢化物中置换出来
C. Y的最高价氧化物对应的水化物能溶于稀氨水
D. 一定条件下,Z单质与W的常见单质直接生成ZW2
难度: 中等查看答案及解析
-
在一定条件下,RO与R-可发生反应:RO3—+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是
A. 元素R位于周期表中第ⅤA族
B. RO3—中的R只能被还原
C. R元素单质在常温常压下一定是气体单质
D. 若1 mol RO3—参与该反应,则转移的电子的物质的量为5 mol
难度: 中等查看答案及解析
-
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是
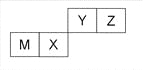
A. 原子半径Z<M
B. Y的最离价氧化物对应水化物的酸性比X 的弱
C. X 的最简单气态氢化物的热稳定性比Z的小
D. Z位于元索周期表中第2 周期、第ⅥA族
难度: 困难查看答案及解析