-
2018 年9月,中国国际能源产业博览会在太原召开。下列关于能源说法不正确的是
A. 煤、石油和天然气的化学能归根到底来自太阳能
B. 在能源的开发和利用中必须同时考虑对环境的影响
C. 天然气是一种高效清洁的能源
D. 我的煤炭储量十分丰富,人类可以无穷无尽地开发
难度: 简单查看答案及解析
-
在密闭容器中进行可逆反应,气体A与B反应生成C,其反应速率分别用VA、VB、VC 表示,三者之间有以下关系:VB=3VA,3VC =2VB,则此反应的化学方程式为( )
A. A(g)+B(g)
C(g)
B. 6A(g)+2B(g)
3C(g)
C. 3A(g)+B(g)
2C(g)
D. A(g)+3B(g)
2C(g)
难度: 中等查看答案及解析
-
某反应使用催化剂后,其反应过程中的能量变化如图,下列说法错误的是( )
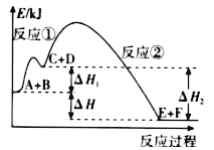
A. 总反应为放热反应 B. 使用催化剂后,活化能不变
C. 反应①是吸热反应 D. △H=△H1+△H2
难度: 中等查看答案及解析
-
如图所示,相同温度下,在容器Ⅰ和Ⅱ中分别充入等物质的量的HI,发生反应2HI(g)
H2(g)+I2(g)。下列关于反应起始时容器Ⅰ和Ⅱ中活化分子的说法不正确的是( )
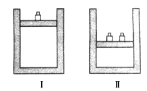
A. Ⅰ和Ⅱ中活化分子数相同
B. Ⅰ和Ⅱ中活化分子百分数相同
C. Ⅰ和Ⅱ中单位体积内活化分子数相等
D. Ⅰ中化学反应速率比Ⅱ中的小
难度: 中等查看答案及解析
-
室温下,设 1L pH=6 的 AlCl3溶液中,由水电离出的 H+物质的量为n1;1L pH=6 的 HCl 溶液中,由水电离出的 H+物质的量为 n2.则 n1/n2的值是( )
A. 0.01 B. 1 C. 10 D. 100
难度: 中等查看答案及解析
-
一种新型火药用高氯酸钾代替硝酸钾,用糖类代替木炭和硫磺,可避免二氧化硫等有害物质的排放,这种新型火药爆炸的热化学方程式:C6H12O6(s)+3KClO4(s)=3KCl(s)+6H2O(g)+6CO2(g) △H=xkJ/mol,已知:葡萄糖的燃烧热:△H1=akJ/mol,KClO4(s)=KCl(s)+2O2(g) △H2=bkJ/mol,H2O(g)= H2O(l) △H3=ckJ/mol,则 x 为()
A. a+3b-6c B. 6c+3a-b C. a+b-6c D. 6c+a-b
难度: 中等查看答案及解析
-
关于水解应用的说法,错误的是( )
A. 在氯化铵的浓溶液中加入镁粉会产生气泡
B. 配制氯化铁溶液时,将氯化铁溶液在较浓的盐酸中再水稀释
C. 硫酸铵和草木灰混合施用到农田可以增强肥效
D. 可用油脂的碱性水解来制备肥皂和甘油
难度: 中等查看答案及解析
-
如图表示钢铁在海水中的锈蚀过程的模型,以下有关说法正确的是 ( )
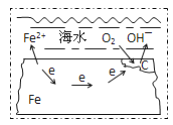
A. 该金属腐蚀过程为析氢腐蚀
B. 正极为 C,发生的反应为氧化反应
C. 在强酸性条件下发生的是吸氧腐蚀
D. 正极反应为: 2H2O+O2+4e-=4OH-
难度: 中等查看答案及解析
-
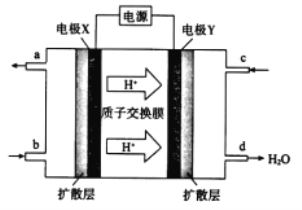
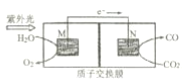
人工光合系统装置(如图)可实现以CO2和 H2O 合成CH4。下列有关说法不正确的是()

A. 该装置中铜为正极
B. 电池工作时H+向Cu电极移动
C. GaN 电极表面的电极反应式为: 2H2O-4e-═O2+4H+
D. 反应CO2+2H2O═CH4+2O2中每消耗 1mol CO2转移 4mol e-
难度: 中等查看答案及解析
-
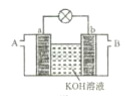
某兴趣小组设计了如图所示原电池装置(盐桥中吸附有K2SO4饱和溶液)。下列说法正确的是()
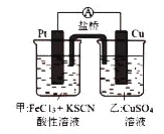
A. 该原电池的正极反应是Cu2++2e-=Cu
B. 甲烧杯中溶液的血红色逐渐变浅
C. 盐桥中的SO42-流向甲烧杯
D. 若将甲烧杯中的溶液换成稀硝酸,电流表指针反向偏转
难度: 中等查看答案及解析
-
下列关于难溶电解质溶解平衡的说法正确的是
A. 可直接根据 Ksp 的数值大小比较难溶电解质在水中的溶解度大小
B. 在 AgCl 的饱和溶液中,加入蒸馏水, Ksp(AgCl)不变
C. 难溶电解质的溶解平衡过程是可逆的,且在平衡状态时 v溶解=v沉淀=0
D. 25℃时, Ksp(AgCl)>Ksp(AgI),向 AgCl 的饱和溶液中加入少量 KI 固体,一定有黄色沉
难度: 中等查看答案及解析
-
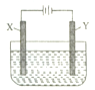
常温下,用铂作电极电解 1L, 1mol·L-1 的氯化钠溶液,当收集到 1.12L 氯气(标准状况)时,溶液的 pH 约为(不考虑气体溶解,忽略溶液体积变化)
A. 1 B. 7 C. 13 D. 14
难度: 中等查看答案及解析
-
常温下,有浓度均为 0.1mol/L、体积均为 100mL 的两种一元酸HX、HY溶液,下列叙述不正确的是()
A. 若此时 HY 溶液的 pH=3,则 HY 是弱酸
B. 若分别加入 0.01molNaOH 固体,则酸碱恰好完全中和
C. 若分别加入 0.01molNaOH 固体,则所得溶液的pH 均为 7
D. 若此时 HX 溶液的 pH=1,则由水电离出的c(H+) =1×10-13 mol/L
难度: 中等查看答案及解析
-
一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知在常温下测得浓度均为0.1mol/L的下列 3 种溶液的 pH:
溶质
NaHCO3
Na2CO3
NaClO
pH
8.34
11.6
10.3
下列有关说法正确的是( )
A. 以上溶液的 pH 是用广泛 pH 试纸测定的
B. 反应CO2+H2O+2NaClO=Na2CO3+2HClO可以发生
C. 室温下,电离常数: K2( H2CO3)>K( HClO)
D. 在新制氯水中加入少量 NaHCO3固体可以提高溶液中 HClO 的浓度
难度: 中等查看答案及解析
-
常温下,下列关于溶液中粒子浓度大小关系的说法正确的是( )
A. 0.1mol/LNa2CO3 溶液中:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
B. 0.1mol/L NH4Cl的溶 液 和 0.1mol/LNH3·H2O的溶液等体积混合后溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C. 醋酸钠溶液中滴加醋酸溶液,则混合溶液一定有:c(Na+)<c(CH3COO-)
D. 0.1 mol/L NaHS 的溶液中: c(OH-)+ c(S2-)= c(H+)+c(H2S)
难度: 困难查看答案及解析
-
测定 0.1 mol/LNa2SO3溶液先升温再降温过程中的 pH ,数据如下。
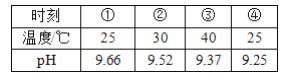
实验过程中,取①、④时刻的溶液,加入盐酸酸化的 BaCl2 溶液做对比实验,④产生白色沉淀多。下列说法不正确的是( )
A. 此实验中 Na2SO3溶液的 pH 是由 pH 计测定的
B. ④与①的 PH 不同,是由于 SO32—浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的 KW值相等
难度: 困难查看答案及解析
-
在 25℃时,密闭容器中 X、 Y、 Z 三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/( mol·L-1)
0.1
0.2
0
平衡浓度/( mol·L-1)
0.05
0.05
0.1
下列说法正确的是
A. 反应达到平衡时, X 和 Y 的转化率相等
B. 增大压强使平衡向生成 Z 的方向移动,平衡常数增大
C. 反应可表示为X+3Y
2Z,其平衡常数为 1600
D. 若该反应的正反应方向为放热反应,升高温度,化学反应速率增大,反应的平衡常数也增大
难度: 困难查看答案及解析
-
已知 Na2SO3和 KIO3 反应过程和机理较复杂,一般认为分以下①~④步反应。
①IO3-+SO32-=IO2-+SO42-(反应速率慢)
②IO2-+2SO32-=I-+2SO42-(反应速率快)
③5I-+IO3-+6H+=3I2+3H2O(反应速率快)
④I2+SO32-+H2O=2I-+SO42-+2H+(反应速率快)
下列说法不正确的是:
A. IO2-和 I-是该反应的催化剂
B. 此反应总反应速率由反应①决定
C. 此反应①中氧化剂是IO3-,反应③中还原剂是 I-
D. 若生成 0.5mol 碘单质,则总反应中有 5mol 电子转移
难度: 中等查看答案及解析
-
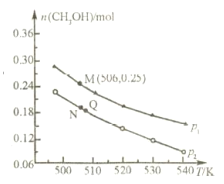
某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的 NaOH 溶液,溶液中pOH 与 pH 的变化关系如图所示,则正确的是( )
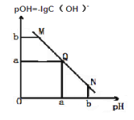
A. M 点所示溶液导电能力强于 Q 点
B. N 点所示溶液中 c(Na+)>c(CH3COO-)
C. Q 点所示的溶液 pH 一定等于 7
D. Q 点加入 NaOH 溶液的体积等于醋酸溶液的体积
难度: 困难查看答案及解析
-
工业上电解 Na2CO3的原理如图所示。下列说法不正确的是( )
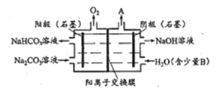
A. 阴极产生的物质 A 是 H2
B. 电解一段时间后,阳极附近溶液的 PH 将增大
C. 该离子交换膜应为阳离子交换膜
D. 阳极电极反应为 4CO32-+2H2O-4e-=4HCO3-+O2↑
难度: 中等查看答案及解析
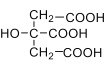 , 其电离常数K1=7.41×10-4,K,2=1.74×10-5,K3=3.98×10-7。碳酸的电离常数K1=4.5×10-7,K1=4.7×10-11。请回答下列有关问题:
, 其电离常数K1=7.41×10-4,K,2=1.74×10-5,K3=3.98×10-7。碳酸的电离常数K1=4.5×10-7,K1=4.7×10-11。请回答下列有关问题: