-
下列叙述正确的是
A. 氯化氢水溶液能导电,所以氯化氢是电解质
B. 固体氯化钠不导电,所以氯化钠是非电解质
C. SO3溶于水能导电,所以SO3是电解质
D. 铜丝能导电,所以铜是电解质
难度: 简单查看答案及解析
-
下列各组中的物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是
A. Fe和FeCl3 B. Na与O2
C. NaOH与CO2 D. NaOH与AlCl3
难度: 中等查看答案及解析
-
配制100mL1.0mol·L-1的NaOH溶液,下列情况会导致溶液浓度偏高的是( )
A. 容量瓶使用前有少量蒸馏水
B. 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C. 在转移过程中有溶液撒在外面
D. 俯视确定凹液面与刻度线相切
难度: 中等查看答案及解析
-
已知15 g A物质和10.5 g B物质恰好完全反应生成7.2 g C、1.8 g D和0.3 mol E,则E物质的摩尔质量是( )
A. 110 g B. 110 g/mol C. 55 g/mol D. 55
难度: 简单查看答案及解析
-
设NA表示阿伏伽德罗常数,下列叙述中正确的是( )
A. 常温常压下,NA个CO2 分子占有的体积为22.4L
B. 物质的量浓度为1mol/L的MgCl2 溶液中含有Cl―个数为2NA
C. 常温常压下,1.06g Na2CO3含有的Na+ 个数为0.02NA
D. 1mol Fe 与足量的稀硫酸反应转化为Fe3+失去的电子数为3NA
难度: 简单查看答案及解析
-
已知5KCl + KClO3 +3H2SO4==3Cl2 + 3K2SO4 + 3H2O ,下列说法不正确的是 ( )
A. H2SO4 既不是氧化剂又不是还原剂
B. 1mol KClO3 参加反应时有5mol电子转移
C. KClO3是氧化剂
D. 被氧化与被还原的氯元素的质量比为1:5
难度: 简单查看答案及解析
-
重金属离子具有毒性。实验室中有甲、乙两种重金属溶液的废液,甲废液经化验呈碱性,主要为有毒离子Ba2+,如将甲、乙两种废液按一定比例混合,毒性明显降低,同时碱性减弱。则乙废液中可能含有的离子是( )
A. Cu2+ 和SO42― B. Cu2+ 和Cl―
C. K+ 和SO42― D. Ag+ 和NO3―
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 钠与水反应:Na+2H2O=Na++2OH―+H2↑
B. 澄清石灰水中通入过量的二氧化碳:CO2+OH―=HCO3―
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH―+H++SO42―=BaSO4↓+H2O
D. 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3―+OH―=CaCO3↓+H2O
难度: 简单查看答案及解析
-
C1O2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得C1O2:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
A. 在反应中H2C2O4既不是氧化剂也不是还原剂
B. 1 mol KClO3参加反应,在标准状况下能得到22.4 L气体
C. 1 mol KClO3参加反应有2 mol电子转移
D. KClO3在反应中是氧化剂
难度: 中等查看答案及解析
-
一定体积CO2和O2的混合气体通过足量的Na2O2后,所得气体体积变为原来的3/4,则CO2在原混合气体中的体积分数为
A. 25% B. 40% C. 50% D. 75%
难度: 中等查看答案及解析
-
某溶液中可能含有H+,Na+,Ba2+,Mg2+,Fe3+,Al3+,SO42﹣,CO32﹣等离子,当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列判断正确的是
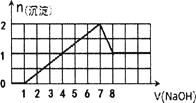
A. 原溶液中一定含有H+、Fe3+、Al3+,可能含Ba2+
B. 原溶液中含Fe3+和Al3+,物质的量之比为l:l
C. 原溶液中可能含有CO32﹣
D. 反应最后形成的溶液中含有的溶质只有NaAlO2
难度: 中等查看答案及解析
-
下列实验现象的描述中不正确的是( )
选项
实验
现象
A
加热放在坩埚中的一小块钠
钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体
B
在酒精灯上加热铝箔
铝箔熔化时失去光泽,熔化的铝并不滴落好像有一层膜包着
C
点燃的镁条伸入盛有O2的集气瓶(底部铺有少量细沙)中
镁条继续燃烧,发出耀眼的白光,放出大量的热,生成白色固体
D
在空气中久置的铝条放入NaOH溶液中
立刻产生大量无色气泡,铝条逐渐变细,放出大量的热
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
将ag Fe2O3 、Al2O3 样品溶解在过量的200mL c(H+)=0.1mol/L的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+ 、Al3+ 刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为( )
A. 0.1mol/L B. 0.2mol/L C. 0.4mol/L D. 0.8mol/L
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数,下列叙述中正确的是
A. 标准状况下,2.24 L CCl4所含的原子数为0.5 NA
B. 100 mL 0.1 mol/L的NaCl溶液中,所含微粒总数为0.02 NA
C. 1.7 g的OH-中含有的电子数为NA
D. 78 g Na2O2与足量水反应转移电子数为2 NA
难度: 简单查看答案及解析