-
银一 Ferrozine法检测甲醛(HCHO)的原理为①在原电池装置中,氧化银能将甲醛充分氧化为CO2;②Fe3+与产生的Ag定量反应生成Fe2+;③Fe2+与 ferrozine形成有色配合物;④测定溶液的吸光度(吸光度与溶液中有色物质的浓度成正比)。下列说法正确的是
A. ①中,负极的电极反应式为2Ag2O+4H++4e-====4Ag+2H2O
B. ①中,溶液中的H+由正极移向负极
C. 理论上消耗的甲醛与生成的Fe2+的物质的量之比为1:4
D. ④中,甲醛浓度越大,吸光度越小
难度: 中等查看答案及解析
-
2018年是“2025中国制造”启动年,而化学与生活生产社会可持续发展密切相关。下列有关化学知识的说法错误的是
A. 碳纳米管表面积大,可用作新型储氢材料
B. 我国发射的“北斗组网卫星”所使用的碳纤维,是一种非金属材料
C. 高纯二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
D. 钾一钠合金可用于原子反应堆的导热剂钾与钠都属于短周期主族元素
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关说法正确的是
A. 32gCu在足量O2或硫蒸气中完全反应失去的电子数均为NA
B. 常温下,0.5LpH=14的Ba(OH)2溶液中OH-数目为NA
C. 标准状况下,5.6L乙烷中含有的极性键数目为1.5NA
D. 一定条件下,32gSO2与足量O2反应,转移的电子数为NA
难度: 中等查看答案及解析
-
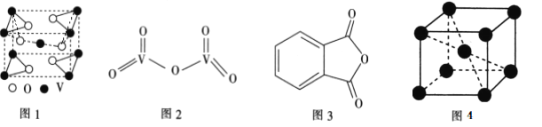
短周期元素W、X、Y、Z的原子序数依次增大。W的单质与H2在暗处能化合并发生爆炸,X是同周期中金属性最强的元素,Y原子的最外层电子数等于其电子层数,W和Z原子的最外层电子数相同。下列说法不正确的是
A. 最简单氢化物的沸点:Z<W
B. 简单离子半径:Y>X
C. W与X形成的化合物溶于水所得的溶液在常温下pH>7
D. X、Y、Z的最高价氧化物对应的水化物两两之间能相互反应
难度: 中等查看答案及解析
-
下列有关1-甲基-1-环己烯(结构简式如图所示)的说法正确的是
A. 该物质含有六元环的同分异构体有3种
B. 分子中所有碳原子在同一平面上
C. 该物质为芳香烃
D. 能使溴的四氯化碳溶液褪色,且反应生成的产物有2种
难度: 中等查看答案及解析
-
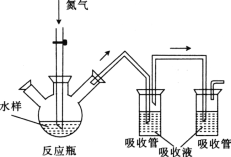
用如图所示装置进行实验,下列对实验现象的解释不合理的是
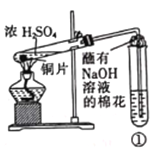
①中试剂
①中现象
解释
A
品红溶液
溶液褪色
SO2具有漂白性
B
Na2SiO3溶液
产生胶状沉淀
酸性:H2SO3>H2SiO3
C
酸性KMnO4溶液
紫色褪去
SO2具有还原性
D
酸性Ba(NO3)2溶液
生成白色沉淀
SO32-与Ba2+生成BaSO3沉淀
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,向10mL1mol·L-1元酸HA溶液中,不断滴加1mol·L-1的NaOH溶液所加碱的体积与-lgc水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是
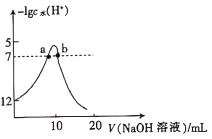
A. 常温下,Kα(HA)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 溶液的导电性逐渐增强
难度: 中等查看答案及解析