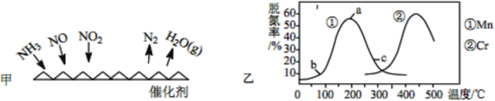-
氮的氧化物NO3是常见的大气污染物,化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
(1)已知:I.2NO(g)=N2(g)+O2(g) △H=-177kJ/mol
II.4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1253.4kJ/mol
则用NH3处理NO生成氮气和气态水的热化学方程式为__________________。
(2)已知:N2(g)+3H2(g)  2NH3(g)△H<0。不同温度下,向三个一样的容器中投入相同的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
2NH3(g)△H<0。不同温度下,向三个一样的容器中投入相同的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
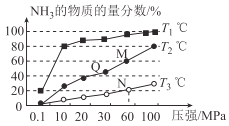
①M点的v正_________Q点的v正(填“>”“<”或“=”),原因是________________________。
②维持10MPa、T3℃的条件不变,要提高H2的转化率,可以采取的措施是__________________(任写一条)。
③图中三条曲线对应的温度T1、T2、T3由高到低的顺序为__________________。
④恒温恒容条件下,能说明反应N2(g)+3H2(g)  2NH3(g)达到平衡状态的是_________(填选项字母)
2NH3(g)达到平衡状态的是_________(填选项字母)
A.c2(NH3)/[c(N2 )c3(H2)]保持不变
B.3mol H-H键断裂的同时,有2mol N-H键断裂
C.2v(N2)=v(NH3)
D.反应器中的压强不再发生变化
⑤T3温度下,将1molN2和3molH2充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,反应的浓度平衡常数Kc=_____________ (mol/L)-2(用最简分数表示),M点的平衡常数比N点的平衡常数_________(填“大”“小”或“相等”)。
-
消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1) 化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
已知:2NO(g)=N2(g)+O2(g) △H=-177kJ/mol
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) △H=-1253.4kJ/mol
则用NH3处理NO生成氮气和气态水的热化学方程式为___________________。
(2)已知:N2(g)+3H2(g)  2NH3(g) △H<0。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
2NH3(g) △H<0。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
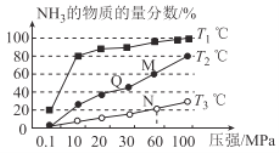
①M点的v正_________Q点的v正(填“>”“<”或“=”)。
②T3温度下,将1molN2和3molH2充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,反应的浓度平衡常数K=_____________ (用最简分数表示),M点的平衡常数比N点的平衡常数_________(填“大”“小”或“相等”)。
(3)水体中过量氨氮(以NH3表示)会导致水体富营养化。
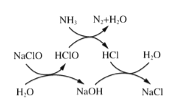
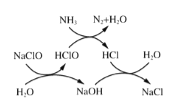
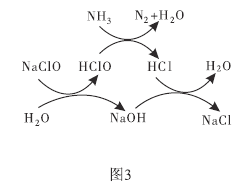
①用次氯酸钠除去氨氮的原理如图所示。写出总反应化学方程式:_____________。
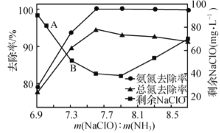
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如上图所示。点B剩余NaClO含量低于点A的原因是____。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是__________。
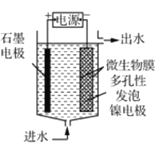
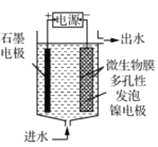
(4)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如题图所示。若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为_____mol。
-
消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1) 化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
已知:2NO(g)=N2(g)+O2(g) △H=-177kJ/mol
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) △H=-1253.4kJ/mol
则用NH3处理NO生成氮气和气态水的热化学方程式为___________________。
(2)已知:N2(g)+3H2(g)  2NH3(g) △H<0。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
2NH3(g) △H<0。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
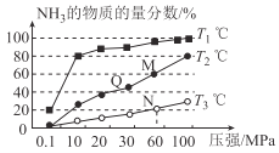
①M点的v正_________Q点的v正(填“>”“<”或“=”)。
②T3温度下,将1molN2和3molH2充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,反应的浓度平衡常数K=_____________ (用最简分数表示),M点的平衡常数比N点的平衡常数_________(填“大”“小”或“相等”)。
(3)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图所示。写出总反应化学方程式:_____________。
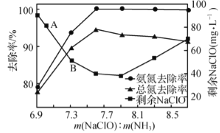
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如上图所示。点B剩余NaClO含量低于点A的原因是____。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是__________。
(4)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如题图所示。若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为_____mol。
-
消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
Ⅰ.化学上采用 处理
处理 不仅可以消除污染,还可作为工业生产的能量来源。
不仅可以消除污染,还可作为工业生产的能量来源。
(1)工业上可采用 的方法合成氨。我国学者采用量子力学方法,通过计算机模拟,研究了在催化剂表面上合成氨的反应历程。图1为各步反应的能量变化示意图,其中“吸”表示各气态物质在催化剂表面吸附。
的方法合成氨。我国学者采用量子力学方法,通过计算机模拟,研究了在催化剂表面上合成氨的反应历程。图1为各步反应的能量变化示意图,其中“吸”表示各气态物质在催化剂表面吸附。
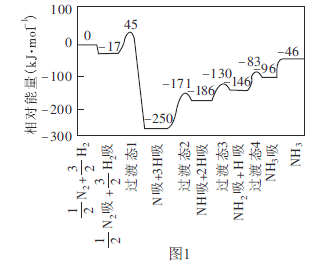
①该反应历程中正反应的最大活化能为________ 。
。
②合成氨反应的热化学方程式为_________________。
(2)不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中 的物质的量分数如图2所示。
的物质的量分数如图2所示。
①M点的 ________N点的
________N点的 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
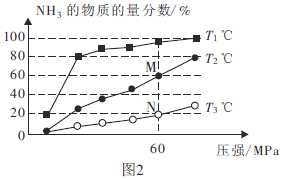
② ℃时,将
℃时,将
 和
和
 充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,化学平衡常数K=________
充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,化学平衡常数K=________ (用最简分数表示)。
(用最简分数表示)。
Ⅱ.废水中的氮常以含氮有机物、氨、硝酸盐及亚硝酸盐等形式存在。
(3)①用次氯酸钠除去氨氮(以 示)的原理如图3所示。写出总反应的化学方程式:______________。
示)的原理如图3所示。写出总反应的化学方程式:______________。
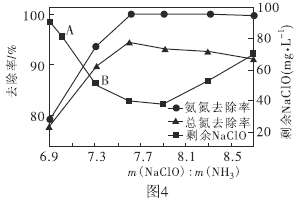
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应相同时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随 的变化情况如图4所示。当
的变化情况如图4所示。当 时,水体中总氮去除率反而下降,可能的原因是________。
时,水体中总氮去除率反而下降,可能的原因是________。
(4)近年来,水体中的硝酸盐含量不断增加。工业上去除废水中硝酸盐的方法是采用电解法将 转化为
转化为 ,部分装置如图5所示。
,部分装置如图5所示。
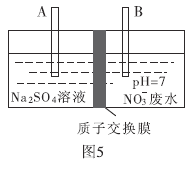
①B电极的电极反应式是________.
②常温下,除去10L废水中的
 后,最终废水的
后,最终废水的 ________(电解前后废水的体积变化忽略不计)。
________(电解前后废水的体积变化忽略不计)。
-
(12分)用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I: 4NH3(g)+6NO(g)  5N2(g)+6H2O(l) △H1
5N2(g)+6H2O(l) △H1
反应II: 2NO(g)+O2(g)  2NO2(g) △H2 (且|△H1| =2|△H2|)
2NO2(g) △H2 (且|△H1| =2|△H2|)
反应III:4NH3(g)+6NO2(g)  5N2(g)+3O2(g)+6H2O(l) △H3
5N2(g)+3O2(g)+6H2O(l) △H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
| 温度/K | 反应I | 反应II | 已知: |
| 298 | K1 | K2 |
| 398 | K1′ | K2′ |
(1)△H3 = (用△H1、△H2 的代数式表示);推测反应III是 反应(填“吸热”或“放热”)
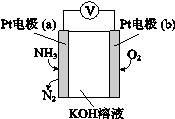
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
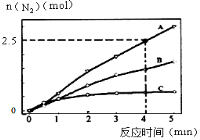
①计算0~4分钟在A催化剂作用下,反应速率v(NO)= 。
②下列说法不正确的是 。
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO)∶n(O2)∶n(NO2)=2∶1∶2。恒温恒压时,在其它条件不变时,再充入NO2气体, NO2体积分数 (填“变大”、“变小”或“不变”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下,溶液中OH-向电极 移动(填a或b),负极的电极反应式为 。
-
(15分)用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I:4NH3(g)+6NO(g)  5N2(g)+6H2O(l) △H1
5N2(g)+6H2O(l) △H1
反应II:2NO(g)+O2(g)  2NO2(g) △H2 (且|△H1| =2|△H2|)
2NO2(g) △H2 (且|△H1| =2|△H2|)
反应III:4NH3(g)+6NO2(g)  5N2(g)+3O2(g)+6H2O(l) △H3
5N2(g)+3O2(g)+6H2O(l) △H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 |
| 398 | K1′ | K2′ |
(1)推测反应III是 反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
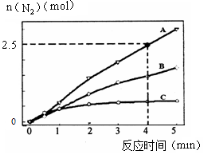
①计算0~4分钟在A催化剂作用下,反应速率v(NO)= 。
②下列说法正确的是 。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO) ∶n(O2)∶n(NO2)=2∶1∶2。在其它条件不变时,再充入NO2气体,分析NO2体积分数——φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2) ;恒温恒容容器,φ(NO2) 。
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3 L,c(N2)与反应时间t变化曲线X如下图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z。则:
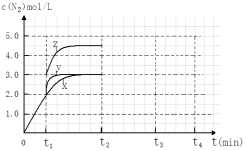
①变为曲线Y改变的条件是 。变为曲线Z改变的条件是 。
②若t2降低温度,t3达到平衡,请在上图中画出曲线X在t2- t4内 c(N2)的变化曲线。
-
用NH3催化还原NxOy可以消除氮氧化物的污染。已知:反应Ⅰ:4NH3(g)+6NO(g) 5N2(g)+6H2O(l) ΔH1
5N2(g)+6H2O(l) ΔH1
反应Ⅱ:2NO(g)+O2(g) 2NO2(g
2NO2(g ) ΔH2(且|ΔH1|=2|ΔH2|)
) ΔH2(且|ΔH1|=2|ΔH2|)
反应Ⅲ:4NH3(g)+6NO2(g) 5N2(g)+3O2(g)+6H2O(l) ΔH3
5N2(g)+3O2(g)+6H2O(l) ΔH3
反应Ⅰ和反应Ⅱ在不同温度时的平衡常数及其大小关系如下表:
| 温度/K | 反应Ⅰ | 反应Ⅱ | 已知:K2>K1>K′2>K′1 |
| 298 | K1 | K2 |
| 398 | K′1 | K′2 |
(1)推测反应Ⅲ是________反应(填“吸热”或“放热”)
(2)相同条件下,反应Ⅰ在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。

①计算0~4分钟在A催化剂作用下,反应速率v(NO)=________。
②下列说法正确的是________。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H—O键与N—H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已达到平衡
(3)一定条件下,反应Ⅱ达到平衡时体系中n(NO)∶n(O2)∶n(NO2)=2∶1∶2。在其他条件不变时,再充入NO2气体,分析NO2体积分数——φ(NO2)的变化情况:恒温恒压容器,φ(NO2)________;恒温恒容容器,φ(NO2)________(填“变大”、“变小”或“不变”)。
(4)一定温度下,反应Ⅲ在容积可变的密闭容器中达到平衡,此时容积为3 L,c(N2)与反应时间t变化曲线X如图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z。则:

①变为曲线Y改变的条件是______________________________________。
变为曲线Z改变的条件是________________________________________。
②若t2时降低温度,t3时达到平衡,请在图中画出曲线X在t2~t4内c(N2)的变化曲线。____________________
-
SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)已知CH4和S的燃烧热分别为a kJ/mol 和b kJ/mol。在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和液态水。反应的热化学方程式为______________。(△H用含a、b的代数式表示)
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2 所示:
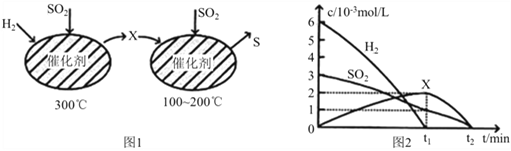
①分析可知X为_______________(写化学式),0~t1时间段的反应温度为_______________,0~t1时间段用SO2表示的化学反应速率为______________________;
②总反应的化学方程式为___________________________________________;
(3)焦炭催化还原SO2生成S2的化学方程式为:2C(s)+2SO2(g) S2(g)+2CO2(g),恒容容器中,lmol/L SO2与足量的焦炭反应,SO2的转化率随温度的变化如图3 所示。
S2(g)+2CO2(g),恒容容器中,lmol/L SO2与足量的焦炭反应,SO2的转化率随温度的变化如图3 所示。
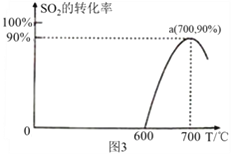
①该反应的ΔH______0(填“>”或“<”);
②700℃的平衡常数为_____________________;
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为___________,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为___________。(已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8)
-
氮的化合物既是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。
(Ⅰ)消除氮氧化物有多种方法。
(1)NH3 催化还原法:原理如图所示
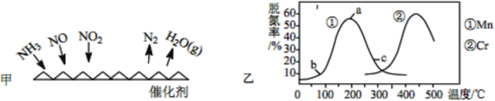
①若烟气中 c(NO2):c(NO)=1∶1,发生如图甲所示的脱氮反应时,反应过程中转移1.5mol电子时放出的热量为 113.8 kJ,则发生该脱氮反应的热化学方程式为___________。
②图乙是在一定时间内,使用不同催化剂 Mn 和 Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为_________;使用 Mn 作催化剂时,脱氮率 b~a 段呈现如图变化的可能原因是__________。
(2)直接电解吸收也是脱硝的一种方法。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如右下图所示。阳极的电极反应式为__________。

(Ⅱ)氨是重要的化工原料,工业合成氨有重要现实意义。
(1)在773K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3,气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
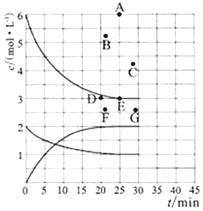
①下列能说明反应达到平衡状态的是____(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4.00mol N2和12.00mol H2,则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为 ___(选填字母)。
(2)在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2,发生如下反应:2NO2(g)⇌N2O4(g) ∆H=-56.9kJ‧mol-1,测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 |
| φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①计算0~20min时,v(N2O4)=____________。
②已知该反应v正(NO2)=k1‧c2(NO2),v逆(N2O4)=k2‧c(N2O4),其中k1、k2为速率常数,则373K时, =_________;改变温度至T1时,k1=k2,则T1_______373K(填“>”“<”或“=”)。
=_________;改变温度至T1时,k1=k2,则T1_______373K(填“>”“<”或“=”)。
-
(9分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,也可用NH3处理,也可用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下2.24L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(2)已知:2SO2(g)+O2(g)  2SO3(g) ?H="-196.6" kJ·mol-1
2SO3(g) ?H="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ?H="-113.0" kJ·mol-1
2NO2(g) ?H="-113.0" kJ·mol-1
(ⅰ)则反应NO2(g)+SO2(g) SO3(g)+NO(g)的?H= ________ kJ·mol-1。
SO3(g)+NO(g)的?H= ________ kJ·mol-1。
(ⅱ)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
A.每消耗1 mol SO3的同时生成1 mol NO2 B. 体系压强保持不变
C. 混合气体颜色保持不变 D. SO3和NO的体积比保持不变
(ⅲ)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图(左)所示。平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)

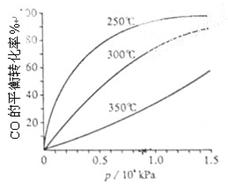
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H ________0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H ________0(填“>”或“ <”)。
2NH3(g)△H<0。不同温度下,向三个一样的容器中投入相同的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。

2NH3(g)达到平衡状态的是_________(填选项字母)