-
(12分)用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I: 4NH3(g)+6NO(g)  5N2(g)+6H2O(l) △H1
5N2(g)+6H2O(l) △H1
反应II: 2NO(g)+O2(g)  2NO2(g) △H2 (且|△H1| =2|△H2|)
2NO2(g) △H2 (且|△H1| =2|△H2|)
反应III:4NH3(g)+6NO2(g)  5N2(g)+3O2(g)+6H2O(l) △H3
5N2(g)+3O2(g)+6H2O(l) △H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
| 温度/K | 反应I | 反应II | 已知: |
| 298 | K1 | K2 |
| 398 | K1′ | K2′ |
(1)△H3 = (用△H1、△H2 的代数式表示);推测反应III是 反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
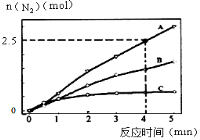
①计算0~4分钟在A催化剂作用下,反应速率v(NO)= 。
②下列说法不正确的是 。
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO)∶n(O2)∶n(NO2)=2∶1∶2。恒温恒压时,在其它条件不变时,再充入NO2气体, NO2体积分数 (填“变大”、“变小”或“不变”)
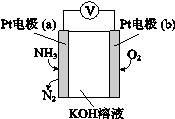
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下,溶液中OH-向电极 移动(填a或b),负极的电极反应式为 。
-
(15分)用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I:4NH3(g)+6NO(g)  5N2(g)+6H2O(l) △H1
5N2(g)+6H2O(l) △H1
反应II:2NO(g)+O2(g)  2NO2(g) △H2 (且|△H1| =2|△H2|)
2NO2(g) △H2 (且|△H1| =2|△H2|)
反应III:4NH3(g)+6NO2(g)  5N2(g)+3O2(g)+6H2O(l) △H3
5N2(g)+3O2(g)+6H2O(l) △H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 |
| 398 | K1′ | K2′ |
(1)推测反应III是 反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
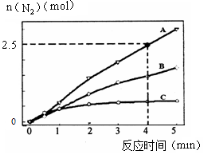
①计算0~4分钟在A催化剂作用下,反应速率v(NO)= 。
②下列说法正确的是 。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO) ∶n(O2)∶n(NO2)=2∶1∶2。在其它条件不变时,再充入NO2气体,分析NO2体积分数——φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2) ;恒温恒容容器,φ(NO2) 。
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3 L,c(N2)与反应时间t变化曲线X如下图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z。则:
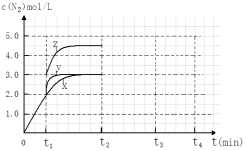
①变为曲线Y改变的条件是 。变为曲线Z改变的条件是 。
②若t2降低温度,t3达到平衡,请在上图中画出曲线X在t2- t4内 c(N2)的变化曲线。
-
用NH3催化还原NxOy可以消除氮氧化物的污染。已知:反应Ⅰ:4NH3(g)+6NO(g) 5N2(g)+6H2O(l) ΔH1
5N2(g)+6H2O(l) ΔH1
反应Ⅱ:2NO(g)+O2(g) 2NO2(g
2NO2(g ) ΔH2(且|ΔH1|=2|ΔH2|)
) ΔH2(且|ΔH1|=2|ΔH2|)
反应Ⅲ:4NH3(g)+6NO2(g) 5N2(g)+3O2(g)+6H2O(l) ΔH3
5N2(g)+3O2(g)+6H2O(l) ΔH3
反应Ⅰ和反应Ⅱ在不同温度时的平衡常数及其大小关系如下表:
| 温度/K | 反应Ⅰ | 反应Ⅱ | 已知:K2>K1>K′2>K′1 |
| 298 | K1 | K2 |
| 398 | K′1 | K′2 |
(1)推测反应Ⅲ是________反应(填“吸热”或“放热”)
(2)相同条件下,反应Ⅰ在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。

①计算0~4分钟在A催化剂作用下,反应速率v(NO)=________。
②下列说法正确的是________。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H—O键与N—H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已达到平衡
(3)一定条件下,反应Ⅱ达到平衡时体系中n(NO)∶n(O2)∶n(NO2)=2∶1∶2。在其他条件不变时,再充入NO2气体,分析NO2体积分数——φ(NO2)的变化情况:恒温恒压容器,φ(NO2)________;恒温恒容容器,φ(NO2)________(填“变大”、“变小”或“不变”)。
(4)一定温度下,反应Ⅲ在容积可变的密闭容器中达到平衡,此时容积为3 L,c(N2)与反应时间t变化曲线X如图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z。则:

①变为曲线Y改变的条件是______________________________________。
变为曲线Z改变的条件是________________________________________。
②若t2时降低温度,t3时达到平衡,请在图中画出曲线X在t2~t4内c(N2)的变化曲线。____________________
-
用NH3催化还原氮的氧化物,可以消除氮的氧化物的污染。已知:
反应①:4NH3(g)+ 6NO(g) 5N2(g) + 6H2O(l)
5N2(g) + 6H2O(l) 
反应②:2NO(g) + O2(g)  2NO2(g)
2NO2(g)  (
(  < 0且
< 0且 =2
=2 )
)
反应③:4NH3(g) + 6NO2(g) 5N2(g)+ 3O2 + 6H2O(l)
5N2(g)+ 3O2 + 6H2O(l) 
反应①和反应②在不同温度时的平衡常数及其大小关心如下表:

(1)试推测反应③是______ 反应(填“吸热”或“放热”)。
(2)相同条件下反应①在2L的密闭容器中选用不同的催化剂,反应产生N2的物质的量随时间的变化如右图所示。
则:①计算0~4min时在A催化剂作用下,反应速率v(NO)=_______________
②下列说法正确的是:________________________
A.该反应的活化能大小顺序是:Ea(A)>Ea(B) >Ea(C)
B.增大压强能使反应速率加快的原因,是因为增加活化分子的百分数
C.单位时间内H-O键与N-H断裂的数目相等时,说明反应已达平衡状态
D.若在恒容绝热的密闭容器中进行,当温度不变时,说明反应已达平衡状态
(3)对于反应②,若在某温度下,在容积为2L的刚性密闭容器中起始加入2 molNO 和2 molO2,反应一段时间后,测的生成NO21.6mol,则该反应是否达到平衡状态?_________(填“是”或“不是”已知该温度下该反应的K约为147.3).达平衡后,在同一温度下向大小相同的另一刚性容器中加入1.2mol的NO2和1.5mol的O2,则还要加入NO______mol、O2_____mol,达平衡时各物质的浓度才能跟前平衡的相等。
-
用NH3催化还原氮的氧化物,可以消除氮的氧化物的污染。已知:
反应①:4NH3(g)+ 6NO(g) 5N2(g) + 6H2O(l) △H1
5N2(g) + 6H2O(l) △H1
反应②:2NO(g) + O2(g) 2NO2(g) △H2(△H2<0且
2NO2(g) △H2(△H2<0且 )
)
反应③:4NH3(g) + 6NO2(g) 5N2(g)+ 3O2 + 6H2O(l) △H3
5N2(g)+ 3O2 + 6H2O(l) △H3
反应①和反应②在不同温度时的平衡常数及其大小关心如下表:

(1)试推测反应③是______ 反应(填“吸热”或“放热”)
(2)相同条件下反应①在2L的密闭容器中选用不同的催化剂,反应产生N2的物质的量随时间的变化如图所示。

则:
①计算0~4min时在A催化剂作用下,反应速率v(NO)=__________。
②下列说法正确的是:__________________。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B) >Ea(C)
B.增大压强能使反应速率加快的原因,是因为增加活化分子的百分数
C.单位时间内H-O键与N-H断裂的数目相等时,说明反应已达平衡状态
D.若在恒容绝热的密闭容器中进行,当温度不变时,说明反应已达平衡状态
(3)对于反应②,若在某温度下,在容积为2L的刚性密闭容器中起始加入2 molNO和2 molO2,反应一段时间后,测的生成NO21.6mol,则该反应是否达到平衡状态?_______(填“是”或“不是”。已知该温度下该反应的K约为147.3)。达平衡后,在同一温度下向大小相同的另一刚性容器中加入1.2mol的NO2和0.9mol的O2,则还要加入NO______mol、O2_____mol,达平衡时各物质的浓度才能跟前平衡的相等。
-
消除含氮、硫等化合物的污染对建设美丽家乡,打造宜居环境具有重要意义。
I.用NH3催化还原NOx可以消除氮氧化物的污染,NOx若以NO为例,在恒容容器中进行反应:4NH3(g)+6NO(g)  5N2(g)+6H2O(g) ΔH<0。
5N2(g)+6H2O(g) ΔH<0。
(1)以下选项可以判断反应达到平衡状态的是_______。
A..4v正(NH3)=5v逆(N2) B.反应体系中气体密度不变
C..反应体系中气体压强不变 D.反应体系中气体平均摩尔质量不变
(2)图I中曲线表示转化率与反应时间的关系。若改变起始条件,使反应过程由a状态转为b状态进行,可采取的措施是_______
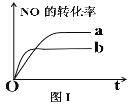
A.降低温度 B.增大反应物中NO的浓度
C.加催化剂 D.向密闭容器中通入氩气
II.燃煤烟气中含有大量SO2和NO。某科研小组研究臭氧氧化的碱吸收法同时脱除SO2和NO工艺,反应进程如图II所示。
反应1:NO(g)+O3(g) NO2(g)+O2(g)
NO2(g)+O2(g)
反应2:SO2(g)+O3(g) SO3(g)+O2(g)
SO3(g)+O2(g)
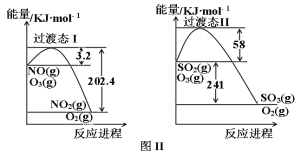
已知该体系中温度80℃以上臭氧发生分解反应:2O3 3O2。且100℃时臭氧的分解率约为10%。请回答:
3O2。且100℃时臭氧的分解率约为10%。请回答:
(1)写出反应1的热化学方程式_______,反应1在高温下不能自发进行,则该反应的熵变ΔS_______0(填“大于”或“小于”)。
(2)其他条件不变,向五个体积固定为1L的密闭容器中均充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0mol O3,在不同温度下反应相同时间后体系中NO和SO2的转化率如图所示:
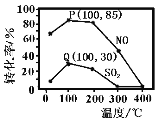
①若P、Q两点为非平衡点,试分析P点转化率大于Q点的可能原因_______。100℃,t秒时反应1进行到P点,反应从开始到t秒时NO的平均速率v(NO)=_______mol·L−1·s−1(用含t的式子表示)。
②若Q点为平衡点,100℃下反应2的平衡常数的数值约为_______(精确到0.01)。
-
已知:用NH3催化还原NOx时包含以下反应。
反应①:4NH3(g) + 6NO(g)  5N2(g) + 6H2O(l) ∆H1 = -1807.0kJ•mol-1
5N2(g) + 6H2O(l) ∆H1 = -1807.0kJ•mol-1
反应②:4NH3(g) + 6NO2(g)  5N2(g) + 3O2(g) + 6H2O(l) ∆H2 = ?
5N2(g) + 3O2(g) + 6H2O(l) ∆H2 = ?
反应③:2NO(g) + O2(g)  2NO2(g) ∆H3 = -113.0kJ•mol-1
2NO2(g) ∆H3 = -113.0kJ•mol-1
(1)反应②的∆H2 =_________________________。 反应①②在热力学上趋势大,其原因是___________________________________________________________________。
(2)为探究温度及不同催化剂对反应①的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得N2浓度变化情况如下图所示。

①反应①的平衡常数的表达式K=__________。在催化剂甲的作用下反应的平衡常数_______________在催化剂乙的作用下反应的平衡常数(填写“大于”,“小于”或“等于”)。
②N点后N2浓度减小的原因可能是_________________、 ________________。
(3)某温度下,在1L容器中对于反应①初始投入4molNH3和6molNO,当气体总物质的量为7.5mol时反应达到平衡,则NH3的转化率_______________% ,达平衡所用时间为5分钟,则用NO表示此反应平均反应速率为__________________。
-
随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中的氮氧化物成为人们关注的主要问题之一。
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g) 5N2(g)+6H2O(l) △H<0
5N2(g)+6H2O(l) △H<0
(1)写出一种可以提高NO的转化率的方法:__________
(2)一定温度下,在恒容密闭容器中按照n(NH3)︰n(NO) =2︰3充入反应物,发生上述反应。下列不能判断该反应达到平衡状态的是___________
A.c(NH3)︰c(NO) =2︰3 B.n(NH3)︰n(N2) 不变 C.容器内压强不变 D.容器内混合气体的密度不变 E.1molN—H键断裂的同时,生成1molO—H键
(3)已知该反应速率v正=k正·c4(NH3)·c6 (NO),v逆=k逆·cx(N2)·cy(H2O) (k正、k逆分别是正、逆反应速率常数),该反应的平衡常数K=k正/k逆,则x=_____,y=_______。
(4)某研究小组将2molNH3、3molNO和一定量的O2充入2L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:
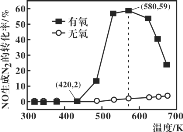
①在5min内,温度从420K升高到580K,此时段内NO的平均反应速率v(NO)=_______;
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是___________。
Ⅱ.用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氮还原率与配比关系如图。
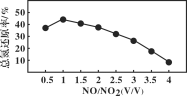
(5) 用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。写出该反应的化学方程式____。
(6)随着NO和NO2配比的提高,总氮还原率降低的主要原因是________________。
-
随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中的氮氧化物成为人们关注的主要问题之一。
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g) 5N2(g)+6H2O(l) △H<0
5N2(g)+6H2O(l) △H<0
(1)写出一种可以提高NO的转化率的方法:__________
(2)一定温度下,在恒容密闭容器中按照n(NH3)︰n(NO) =2︰3充入反应物,发生上述反应。下列不能判断该反应达到平衡状态的是___________
A.c(NH3)︰c(NO) =2︰3 B.n(NH3)︰n(N2) 不变 C.容器内压强不变 D.容器内混合气体的密度不变 E.1molN—H键断裂的同时,生成1molO—H键
(3)已知该反应速率v正=k正·c4(NH3)·c6 (NO),v逆=k逆·cx(N2)·cy(H2O) (k正、k逆分别是正、逆反应速率常数),该反应的平衡常数K=k正/k逆,则x=_____,y=_______。
(4)某研究小组将2molNH3、3molNO和一定量的O2充入2L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:
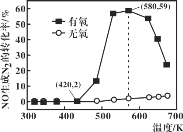
①在5min内,温度从420K升高到580K,此时段内NO的平均反应速率v(NO)=_______;
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是___________。
Ⅱ.用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氮还原率与配比关系如图。
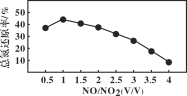
(5) 用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。写出该反应的化学方程式____。
(6)随着NO和NO2配比的提高,总氮还原率降低的主要原因是________________。
-
随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中的氮氧化物成为人们关注的主要问题之一。
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g) 5N2(g)+6H2O(l) △H<0
5N2(g)+6H2O(l) △H<0
(1)写出一种可以提高NO的转化率的方法:__________
(2)一定温度下,在恒容密闭容器中按照n(NH3)︰n(NO) =2︰3充入反应物,发生上述反应。下列不能判断该反应达到平衡状态的是___________
A.c(NH3)︰c(NO) =2︰3 B.n(NH3)︰n(N2) 不变 C.容器内压强不变 D.容器内混合气体的密度不变 E.1molN—H键断裂的同时,生成1molO—H键
(3)已知该反应速率v正=k正·c4(NH3)·c6 (NO),v逆=k逆·cx(N2)·cy(H2O) (k正、k逆分别是正、逆反应速率常数),该反应的平衡常数K=k正/k逆,则x=_____,y=_______。
(4)某研究小组将2molNH3、3molNO和一定量的O2充入2L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:
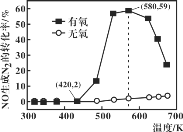
①在5min内,温度从420K升高到580K,此时段内NO的平均反应速率v(NO)=_______;
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是___________。
Ⅱ.用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氮还原率与配比关系如图。
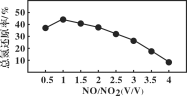
(5) 用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。写出该反应的化学方程式____。
(6)随着NO和NO2配比的提高,总氮还原率降低的主要原因是________________。
5N2(g)+6H2O(l) △H1
2NO2(g) △H2 (且|△H1| =2|△H2|)
5N2(g)+3O2(g)+6H2O(l) △H3



















