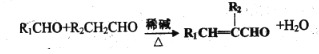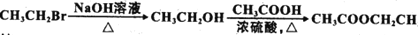-
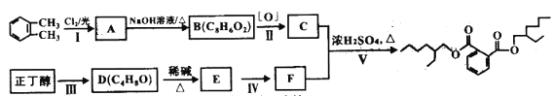
某石化公司“碳九”装船作业时发生泄漏,造成环境污染。“碳九”是指含九个碳原子的芳香烃,下列关于“碳九”的说法不正确的是
A. 属于易燃危险品 B. 能与浓硫酸和浓硝酸的混合液反应
C. 只含碳、氢元素 D. 1,2,3-三甲基苯属于“碳九”,其一氯代物有5种
难度: 中等查看答案及解析
-
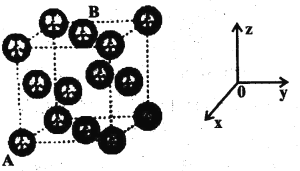
Q、W、X、Y是原子序数依次增大的短周期元素。W、X是金属元素,其最高价氧化物的水化物间反应生成盐和水;Q的最外层电子数是核外电子层数的3倍,W与Y可形成化合物W2Y。下列说法正确的是
A. W的各氧化物中只含有离子键 B. Y的正四价氧化物与Q3漂白的原理相同
C. 在水溶液中可制得X2Y3沉淀 D. 四种元素形成的简单离子中,X的半径最小
难度: 困难查看答案及解析
-
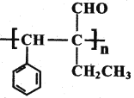
脱落酸有催熟作用,其结构简式如图所示。下列关于脱落酸的说法错误的是
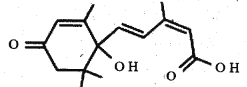
A. 分子式为C15H20O4
B. 一定条件下可以发生酯化、加聚、氧化反应
C. 所有碳原子不可能共平面
D. 1mol的脱落酸能与2mol的 NaHCO3发生反应
难度: 中等查看答案及解析
-
一定条件下,在水溶液中1 mol ClOx-(x=0,1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法错误的是
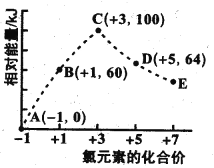
A. 上述离子中结合H能力最强的是E
B. 上述离子中最稳定的是A
C. C→B+D反应的热化学方程式为2ClO2-(aq)=ClO3-(ag)+ClO-(aq) △H=-76kJ·mol-1
D. B→A+D的反应物的键能之和小于生成物的键能之和
难度: 中等查看答案及解析
-
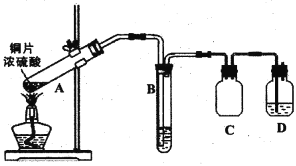
某兴趣小组采用下图实验装置及相应操作制取纯碱。实验时,广口瓶中反应的化学方程式为:NH3+CO2+H2O+NaCl= NaHCO3↓+NH4Cl。下列分析正确的是
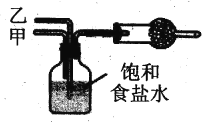
A. 导气管乙应该通入氨气
B. 导气管甲应先于乙通入气体
C. 干燥管中应盛装碱石灰
D. 广口瓶最好置于热水浴中
难度: 中等查看答案及解析
-
高能锂离子电池总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法正确的是
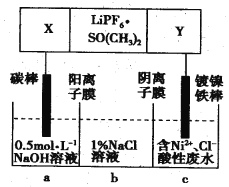
A. LiPF6·SO(CH3)2可用Li2SO4水溶液代替
B. 当转移1mol e-时,b室离子数增加NA个
C. 该电池充电时阳极反应式为Fe+Li2S-2e-=FeS+2Li+
D. 若去除图阴离子膜,则电解反应总方程式发生改变
难度: 困难查看答案及解析
-
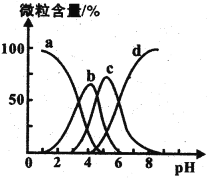
已知:pKa=-lgKa。25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1 mol·L-1 NaOH溶液滴定20mL0.1mol·L-1H2A溶液的滴定曲线如图所示。下列说法不正确的是
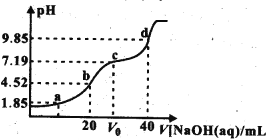
A. a点溶液中:c(HA-)=c(H2A)
B. b点溶液中:A2-水解平衡常数Kh1=10-6.81
C. c点溶液中:V0=30
D. a、b、c、d四点中,d点溶液中水的电离程度最大
难度: 困难查看答案及解析