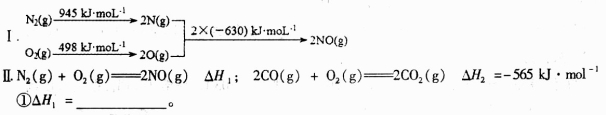-
氮氧化物是环境污染物,研究氮氧化物转化有重要的意义。
回答下列问题
(1)催化转化器可使汽车尾气反应而转化:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
已知:N2(g)+O2(g)==2NO(g) △H1= a kJ·mol-1
2C(s)+O2(g)==2CO(g) △H2= b kJ·mol-1
C(s)+ O2(g)=CO2(g) △H3= c kJ·mol-1
△H=___________ kJ·mol-1(用含a、b、c的代数式表示)
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中发生尾气转化反应,容器中NO物质的量随时间变化如图所示。
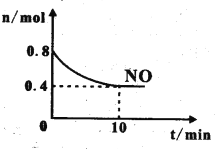
①T℃时,该化学反应的平衡常数K=___________。
②下列事实无法判断汽车尾气转化反应达到到化学平衡状态的是___________;
A.NO消耗速率等于N2消耗速率的2倍 B.混合气体平均相对分子质量不再变化
C.体系中NO的转化率和CO的转化率相等 D.气体的密度不再变化
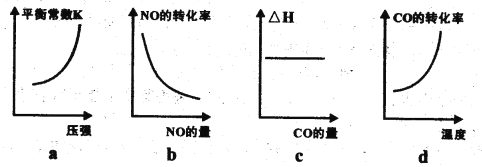
③已知汽车尾气转化反应的△H<0。10min后,改变下列示意图横坐标对应的反应条件,纵坐标对应的量变化关系正确的是___________。(填序号)
(3)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g) 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)0.5(k为速率常数)。下列表述正确的是___________(填标号)。
A.N2O分解反应中,k值与是否含碘蒸气无关
B.第二步对总反应速率起决定作用
C.第二步活化能比第三步小
D.IO为反应的中间产物
(4)碱吸收、碳还原是目前工业生产中处理氮氧化物的常用方法。
①碱吸收的常见产物为NaNO2。常温下,pH=8的NaNO2溶液中c(Na+)-c(NO2-)=___________mol·L-1(用精确值表示)
②碳还原法是在高温条件下将NO与NO2混合气体与焦炭反应,生成CO和N2。已知,采用碳还原法处理某工厂氮氧化物废气时,生成的CO与N2的物质的量之比为4︰3。则该工厂尾气中NO和NO2的物质的量比为___________。
-
研究氮的氧化物、硫的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物转化为无毒物质。下列说法能说明恒温恒容条件下的反应;2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ·mol-1已达到化学平衡的是 。
A.单位时间内消耗了2moINO的同时消耗的2moICO
B.CO与CO2的物质的量浓度相等的状态
C.气体密度保持不变的状态
D.气体平均摩尔质量保持不变的状态
(2)NO2与SO2混合可发生反应:NO2(g)+SO2(g) SO3(g)+NO(g)。
SO3(g)+NO(g)。
将一定量的NO2与SO2置于绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的趋势如图所示。由图(纵轴代表正反应速率)可知下列说法正确的是 (填字母)。
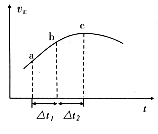
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.△t1=△t2时,SO2的消耗量:a~b段大于b~c段
(3)CO在实际中有以下应用:用Li2CO3和Na2CO3熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气作为正极助燃气,制得在650℃下工作的燃料电池。完成有关的电极反应式。
负极反应式:2CO+2CO32-一4e-=4CO2 正极反应式: 。
(4)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图:
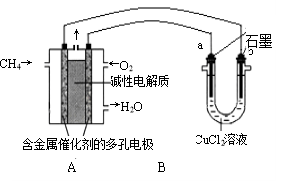
请回答:①甲烷燃料电池的负极反应式是 。
②当A中消耗0.15 mol氧气时,B中 极(填”a”或”b”)增重__ __g。
-
治理汽车尾气和燃煤尾气是环境保护的重要课题.请回答下列问题:
(1)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g)  2CO2(g)+N2(g).在恒容密闭容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示.
2CO2(g)+N2(g).在恒容密闭容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示.
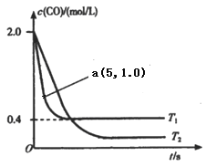
①据此判断该反应的正反应为____(填“放热”或“吸热”)反应.
②温度T1时,该反应的平衡常数K=_____;反应速率v=v(正)-v(逆)=k正c2(NO)c2(CO)- k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,计算a处v(正):v(逆)=________.
(2)下图流程是一种新型的除去尾气中氮氧化物的技术,一般采用氨气或尿素作还原剂
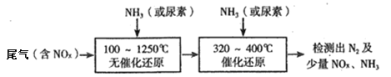
该技术中用尿素[CO(NH2)2]作还原剂还原NO2的主要反应为:4CO(NH2)2+6NO2 4CO2+7N2+8H2O ,则用NH3作还原剂还原尾气中NO(NH3、NO的物质的量之比为1:1)的化学方程式为:______.
4CO2+7N2+8H2O ,则用NH3作还原剂还原尾气中NO(NH3、NO的物质的量之比为1:1)的化学方程式为:______.
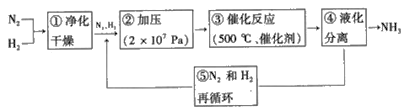
(3)哈伯法合成氨的流程图如图,下列五个流程中为提高原料利用率而采取的措施________(填序号)
(4)一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+.下列叙述正确的是______________(填选项)

A.Pd电极b为阴极 B.阴极的反应式为N2+6H++6e-=2NH3
C.H+由阳极向阴极迁移 D.陶瓷可以隔离N2和H2
(5)也可用CH4催化还原NOx法消除烟气中氮氧化物的污染.已知:
①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②N2(g)+2O2(g)= 2NO2(g) △H=+67.0 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
则CH4催化还原NO的热化学方程式为__________________________________.
-
近年来雾霾天气经常出现,研究雾霾成因和治理是当前环保的重要话题。汽车尾气和燃煤是造成空气污染的原因之一。因此研究氮氧化物的反应机理,对消除和防治环境污染有重要意义。
(1)①对于2NO(g)+2H2(g)=N2(g)+2H2O(g) △H=-665kJ/mol的反应分三步完成:
a:2NO(g)=N2O2(g)(快)
b:N2O2(g)+H2(g)=N2O(g)+H2O(g)(慢)
c:N2O(g)+H2(g)=N2(g)+H2O(g)(快)
决定此总反应速率的是第步的反应___(填序号)。
②已知:H2(g)+CO2(g)=H2O(g)+CO(g) △H=+41kJ/mol
汽车尾气的净化原理主要是用催化剂把NO与CO反应转化为两种对大气无污染的气体,试写出该反应的热化学方程式:___。
(2)升高温度能让绝大多数的化学反应加快反应速率,但是研究发现2NO(g)+O2(g)=2NO2(g) △H<0存在一些特殊现象。现有某化学小组通过实验测得不同温度下该反应速率常数k(代表反应速率的一个常数)的数值如表:
| T(K) | k | T(K) | k | T(K) | k |
| 143 | 1.48×105 | 273 | 1.04×104 | 514 | 3.00×103 |
| 195 | 2.58×104 | 333 | 5.50×103 | 613 | 2.80×103 |
| 254 | 1.30×104 | 414 | 4.00×103 | 663 | 2.50×103 |
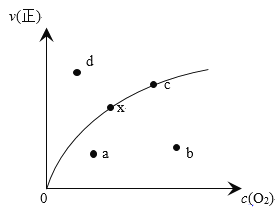
由实验数据测到v正与c(O2)的关系如图1所示,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___点(填字母),并解析原因:
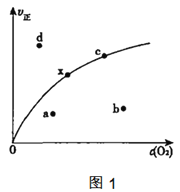
①___
②___
(3)NOx的排放主要来自于汽车尾气,包含NO2和NO,有人得出用活性炭对NOx进行吸收,发生如下反应:
反应a:C(s)+2NO(g)⇌N2(g)+CO2(g) △H=-34.0kJ/mol
反应b:2C(s)+2NO2(g)⇌N2(g)+2CO2(g) △H=-64.2kJ/mol
对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如表:
| 时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0〜10min内,NO的平均反应速率v(NO)=___,当升高反应温度,该反应的平衡常数K___(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___(填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
(4)实验室模拟反应2C(s)+2NO2(g)=N2(g)+2CO2(g) △H=-64.2kJ/mol,在密闭容器中加入一定量的碳和NO2,维持温度是T2℃,如图2为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。
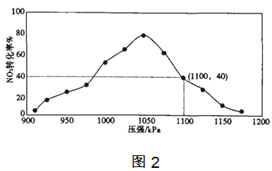
①请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因___;
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数___(用计算表达式表示,不必化简);已知:气体分压(p分)=气体总压(p总)×体积分数。
-
近年来,汽车尾气催化净化成为极其重要的环保产业。请回答下列问题:
I.治理汽车尾气中NO和CO的一种方法是在汽车的排气管道上安装一个催化转化装置。发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
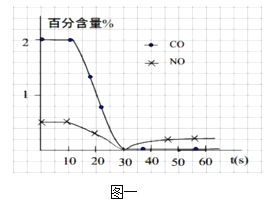
(1)实际测试某汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线如图一,0~10 s阶段,CO、NO百分含量没有明显变化的原因是______;
(2)在密闭容器中充入10 mol CO和8 mol NO发生反应,测得平衡时NO的体积分数与温度、压强的关系如图二。
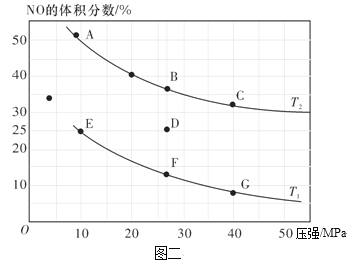
①已知T2>T1,则反应2NO(g)+2CO(g) N2(g)+2CO2(g),△H___0(填“>”、“=”或“<”)。
N2(g)+2CO2(g),△H___0(填“>”、“=”或“<”)。
②为同时提高反应速率和NO的平衡转化率,可采取的措施有______(填字母序号)。
a.改用高效催化剂 b.缩小容器的体积
c.增加CO的浓度 d.升高温度
③压强为10MPa、温度为T1下,该温度下用分压表示的平衡常数Kp=___MPa-1(分压=总压×物质的量分数)。
II.汽车尾气中CO与N2O会发生反应:N2O(g)+CO(g) CO2(g)+N2(g) ΔH。几种物质的相对能量如下:
CO2(g)+N2(g) ΔH。几种物质的相对能量如下:
| 物质 | N2O(g) | CO(g) | CO2(g) | N2(g) |
| 相对能量/ kJ/mol | 475.5 | 283 | 0 | 393.5 |
(3)ΔH=___kJ/mol。
(4)实验室用Fe+作催化剂,以N2O和CO投入比为1:1模拟上述反应,其总反应分两步进行:
第一步:Fe++N2O FeO++N2;
FeO++N2;
第二步:___(写反应方程式)。
催化过程中,c(N2)和c(CO2)几乎相等,由此判断该反应进行的快慢由第___步反应决定。
请在如图中绘制反应在催化剂作用下的“能量~反应过程”示意图___。已知:两步反应均放热。

-
近年来雾霾天气经常肆虐北京、天津、河北等地区,其中汽车尾气和燃煤是造成空气污染的原因之一。因此研究氮氧化物的反应机理,对消除和防治环境污染有重要意义。
(1) 对于2NO(g) + 2H2(g) = N2(g) + 2H2O(g) △H = − 665 kJ/mol 的反应分三步完成:
① 2NO(g) = N2O2(g) (快)
② N2O2(g) + H2(g) = N2O(g) + H2O(g) (慢)
③ ______________________________ (快),请完成第③步的化学方程式。因此决定此总反应速率的是第_____步的反应。(填序号)
(2) 已知:H2(g) + CO2(g) = H2O(g) + CO(g) △H = + 41 kJ/mol汽车尾气的净化原理主要是用催化剂把NO与CO反应转化为两种对大气无污染的气体,试写出该反应的热化学方程式:______________。
该反应在一定条件下达到平衡后,为了能加快反应速率并让反应向正方向移动,可采取的措施有:(__________)
A.适当升高温度 B.适当降低温度 C.压缩体积增大压强 D.使用正催化剂
该反应采取上述措施重新达到平衡后K值将______(填“增大”、“减小”和“不变”)
(3) 升高温度能让绝大多数的化学反应加快反应速率,但是研究发现2NO(g) + O2(g) = 2NO2(g) △H < 0 存在一些特殊现象。现有某化学小组通过实验测得不同温度下该反应速率常数k (代表反应速率的一个常数)的数值如下表:
| T(K) | k | T(K) | k | T(K) | k |
| 143 | 1.48 × 105 | 273 | 1.04 × 104 | 514 | 3.00 × 103 |
| 195 | 2.58 × 104 | 333 | 5.50 × 103 | 613 | 2.80 × 103 |
| 254 | 1.30 × 104 | 414 | 4.00 × 103 | 663 | 2.50 × 103 |
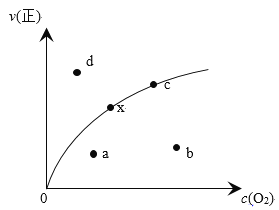
由实验数据测到v(正)~c(O2)的关系如图所示,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为_____点(填字母),并解析原因:①__________,②__________。
-
近年来雾霾天气经常肆虐北京、天津、河北等地区,其中汽车尾气和燃煤是造成空气污染的原因之一。因此研究氮氧化物的反应机理,对消除和防治环境污染有重要意义。
(1) 对于2NO(g) + 2H2(g) = N2(g) + 2H2O(g) △H = − 665 kJ/mol 的反应分三步完成:
① 2NO(g) = N2O2(g) (快)
② N2O2(g) + H2(g) = N2O(g) + H2O(g) (慢)
③ ______________________________ (快),请完成第③步的化学方程式。因此决定此总反应速率的是第_____步的反应。(填序号)
(2) 已知:H2(g) + CO2(g) = H2O(g) + CO(g) △H = + 41 kJ/mol汽车尾气的净化原理主要是用催化剂把NO与CO反应转化为两种对大气无污染的气体,试写出该反应的热化学方程式:______________。
该反应在一定条件下达到平衡后,为了能加快反应速率并让反应向正方向移动,可采取的措施有:(__________)
A.适当升高温度 B.适当降低温度 C.压缩体积增大压强 D.使用正催化剂
该反应采取上述措施重新达到平衡后K值将______(填“增大”、“减小”和“不变”)
(3) 升高温度能让绝大多数的化学反应加快反应速率,但是研究发现2NO(g) + O2(g) = 2NO2(g) △H < 0 存在一些特殊现象。现有某化学小组通过实验测得不同温度下该反应速率常数k (代表反应速率的一个常数)的数值如下表:
| T(K) | k | T(K) | k | T(K) | k |
| 143 | 1.48 × 105 | 273 | 1.04 × 104 | 514 | 3.00 × 103 |
| 195 | 2.58 × 104 | 333 | 5.50 × 103 | 613 | 2.80 × 103 |
| 254 | 1.30 × 104 | 414 | 4.00 × 103 | 663 | 2.50 × 103 |
由实验数据测到v(正)~c(O2)的关系如图所示,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为_____点(填字母),并解析原因:①__________,②__________。
-
(20分)碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。请回答:
(1)消除汽车尾气中的NO、CO,有利于减少对环境的污染。已知如下信息:
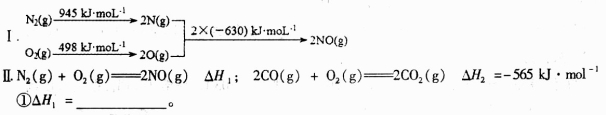
②在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式___________________。
(2)在催化剂作用下,CO2和H2可以制取甲醇,在体积为2L的密闭容器中,充入lmolCO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0
CH3OH(g)+H2O(g) △H<0
测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如下图所示:
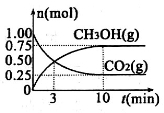
①从反应开始到平衡,H2O的平均反应速率v(H2O)=_________________________。此反应的平衡常数为_________________。
②下列措施中能使化学平衡向正反应方向移动的是_________________(填序号)
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入1 molCO2和4molH2
(3)用间接电化学法除去NO的过程,如图所示:已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:____________。用离子方程式表示吸收池中除去NO的原理:________________。

(4)①工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是,用文字和化学用语解释原因__________________。
②废气中的SO2可用NaOH溶液吸收,吸收SO2后的碱性溶液还可用于C12的尾气处理,吸收C12后的溶液仍呈强碱性。则吸收C12后的溶液中一定存在的阴离子有OH-_____、_____;还可能存在SO32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液。此实验不能证明溶液中含有SO32-,理由是:________________(用离子方程式表示)。
-
研究NOx、CO等大气污染物的测量及处理具有重要意义。
(1)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。NOx在催化转化器中被CO还原成N2排除。写出NO被CO还原的化学方程式:________________。
(2)选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在金属催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O。
①已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H=-905.5kJ•mol-1
4NO(g)+6H2O(g)△H=-905.5kJ•mol-1
N2(g)+O2(g) 2NO(g)△H=+180kJ•mol-1
2NO(g)△H=+180kJ•mol-1
完成该方法中主要反应的热化学方程式
4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g)△H=_________________。
4N2(g)+6H2O(g)△H=_________________。
②该方法应控制反应温度在315~400℃之间,反应温度过低会影响反应速率,但温度也不宜过高,原因是___________________。
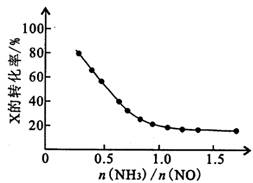
③氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,反应物x的转化率与氨氮比的关系如右图所示,则X是________________ (填化学式)。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是________________ 。
(3)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
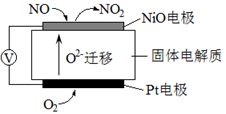
①Pt电极上发生的是______________反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:___________________________________。
-
(14分)能源开发、环境保护、资源利用等是当今社会的热门话题。请根据所学化学知识回答下列问题:
(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ · mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ · mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ · mol-1
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)汽车尾气分析仪对CO的含量分析是以燃料电池为工作原理,其装置如下图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质中自由移动。

下列说法中正确的是_____________(填字母序号)。
A.负极的电极反应式为:CO + O2-―2e-=CO2
B.工作时电子由电极a通过传感器流向电极b
C.工作时电极b作正极,O2-由电极a通过固体介质向电极b迁移
D.传感器中通过的电流越大,尾气中CO的含量越高
(3)某硝酸厂利用甲醇处理废水。在一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比为______________。
(4)煤的间接液化是先转化为CO和H2,再在催化剂作用下合成甲醇。若在一定温度下,向1 L密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)  CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
| 物 质 | CO | H2 | CH3OH |
| 浓度/(mol·L-1) | 1.2 | 1.0 | 0.6 |
① 该反应的平衡常数表达式为:K=_____________________。
② 该时间内反应速率v(H2)=_________________。
③ 平衡时CO的转化率为_________________(保留1位小数)。
N2(g)+2CO2(g) △H


2I(g)(快反应)