-
在溶液中,能大量共存的离子组是
A. Na+、H+、HCO3-、NO3-
B. Mg2+、OH-、SO42-、NO3-
C. K+、Fe3+、SO42-、NO3-
D. Na+、H+、Cl-、OH-
难度: 简单查看答案及解析
-
下列物质的用途或者制备中所涉及到的离子方程式书写正确的是
选项
用途或者制备
离子方程式
A
用稀硫酸清洗铁锈
Fe2O3+6H+=2Fe2++3H2O
B
实验室用大理石与稀盐酸反应制备二氧化碳
CO32-+2H+ =H2O+CO2↑
C
用氢氧化钠溶液吸收氯气
Cl2 + 2OH-=Cl-+ClO-+H2O
D
用氯化铁溶液刻蚀铜板
Fe3+ + Cu =Fe2++Cu2+
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列各组离子中,能在水溶液中大量共存的是
A. Na+、Ag+、Cl-、CO32— B. Na+、Mg2+、Cl-、SO42—
C. Fe3+、K+、SO42—、OH- D. Fe2+、H+、SO42-、NO3—
难度: 简单查看答案及解析
-
配制100 mL 1 mol/L的NaCl溶液时,下列做法不正确的是
A. 选择容积100 mL的容量瓶
B. 在容量瓶中溶解NaCl固体
C. 转移NaCl溶液时用玻璃棒引流
D. 定容时向容量瓶中滴加蒸馏水至液面与刻度线相切
难度: 简单查看答案及解析
-
下列说法正确的是
A. NaCl的摩尔质量是58.5 g
B. 标准状况下,22.4 L水中约含6.02×1023个H2O分子
C. 常温常压下,22 g CO2中所含氧原子数约为6.02×1023
D. 将40 g NaOH固体溶于1 L H2O中,得到1 mol/L的NaOH溶液
难度: 简单查看答案及解析
-
下列“实验结论”与“实验操作及现象”相符的一组是
选项
实验操作及现象
实验结论
A
向某溶液中加入NaOH溶液,立即产生红褐色沉淀
该溶液中一定含有Fe3+
B
向某溶液中加入KSCN溶液,溶液变为红色
该溶液中一定含有Fe2+
C
向某溶液中加入BaCl2溶液,有白色沉淀生成
该溶液中一定含有SO42-
D
向某溶液中加入稀盐酸,有无色气体产生
该溶液中一定含有CO32-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关试剂保存的说法中,不正确的是
A. 保存FeCl3溶液时需加入少量Fe粉 B. Na可保存在煤油中
C. NaOH固体需要密封保存 D. 新制氯水需要避光保存
难度: 中等查看答案及解析
-
下列实验能达到目的的是
A. 加热除去NaHCO3固体中的Na2CO3
B. 用NaOH溶液除去CO2中的SO2气体
C. 用双氧水除去Fe2(SO4)3溶液中的少量FeSO4
D. 用BaCl2溶液除去NaCl溶液中的K2SO4
难度: 中等查看答案及解析
-
下列有关实验现象与物质性质对应关系的说法中,错误的是
A. Na2CO3溶液遇酚酞变红,说明Na2CO3溶液呈碱性
B. NO遇空气变为红棕色,说明NO具有还原性
C. Cl2使湿润的有色布条褪色,说明Cl2具有漂白性
D. 新制的Fe(OH)2遇氧气最终变为红褐色,说明Fe(OH)2具有还原性
难度: 中等查看答案及解析
-
下列关于Na2CO3和NaHCO3的说法中,不正确的是
A. 均属于盐
B. 焰色反应均为黄色
C. 可以用加热的方法除去Na2CO3固体中的NaHCO3杂质
D. 物质的量相同的两种固体分别与足量盐酸反应,Na2CO3产生的二氧化碳多
难度: 简单查看答案及解析
-
将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成。X、Y不可能是
选项
X
Y
A
SO2
NO2
B
SO2
H2S
C
NH3
SO2
D
Cl2
CO2
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列操作能够达到实验目的的是
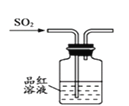
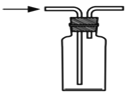

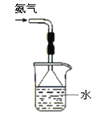
A.验证一定生成SO2
B. 用排空气法收集NO
C. 制取并检验氨气
D.用水吸收氨气
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法中,不正确的是
A. 0.1 mol N2的质量是2.8 g
B. Mg的摩尔质量是24 g/mol
C. 2 L 0.1mol·L-1NaCl溶液中,c(Na+)=0.2mol·L-1
D. 标准状况下,11.2 L O2含有的原子数目约为6.02×1023
难度: 中等查看答案及解析
-
工业上用洗净的废铜屑做原料来制备硝酸铜,从节约原理及防治污染环境的角度考虑,宜采取的方法是
A. Cu+HNO3(浓)→Cu(NO3) 2
B. Cu+HNO3(稀)→Cu(NO3) 2
C. Cu
CuO
Cu(NO3)2
D. Cu
CuSO4
Cu(NO3)2
难度: 中等查看答案及解析
-
在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示:

下列说法不正确的是
A. 该转化过程中有3种元素的化合价发生变化
B. NO 和O2必须在催化剂表面才能反应
C. 该装置将有毒的NO和CO转化为无毒的CO2和N2
D. 该催化转化的总反应方程式为:2NO+O2+4CO
4CO2+N2
难度: 中等查看答案及解析
-
下列说法正确的是
A. 向FeBr2溶液中通入少量Cl2,发生反应的离子方程式为:2Br- + Cl2 = Br2 + 2Cl-
B. 向含碘化钾、淀粉的溶液中滴加FeCl3溶液,溶液变蓝
C. 某溶液中含有Fe2+、Cl-、I-,为了除去I-而不减少其他离子,可通入过量氯气
D. 向含有NaBr、NaI的溶液中通入适量氯气,充分作用后,将溶液蒸干、灼烧,可能得到NaCl和NaI的固体混合物
难度: 困难查看答案及解析
-
某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
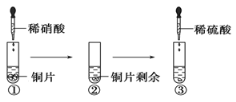
①、③均观察到实验现象:溶液呈蓝色,试管口有红棕色气体产生。下列说法正确的是
A. ①试管口有红棕色气体产生,原因是硝酸被还原为NO2
B. 由③的现象可得出结论:Cu可与稀硫酸反应
C. ③中反应的离子方程式:3Cu+2NO3-+8H+ === 3Cu2++2NO↑+4H2O
D. ③中可能产生SO2
难度: 中等查看答案及解析
-
在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法
现象
结论
A
观察氯水颜色
氯水呈黄绿色
氯水中含Cl2
B
向饱和NaHCO3溶液中加入足量氯水
有无色气体产生
氯水中含HClO
C
向红色纸条上滴加氯水
红色纸条褪色
氯水具有漂白性
D
向FeCl2溶液中滴加氯水
溶液变成棕黄色
氯水具有氧化性
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与11.2 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则消耗铜的质量为
A. 32 g B. 48 g C. 64 g D. 96 g
难度: 困难查看答案及解析
-
将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体A,则产生白色沉淀。制备气体A的试剂不能是

A. 大理石和稀盐酸
B. NaOH和NH4Cl
C. Cu和浓硝酸
D. MnO2和浓盐酸
难度: 中等查看答案及解析
-
在标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1L水中,所得溶液的密度为ρg·cm-3,则此溶液的物质的量浓度(mol/L)为
A.
B.
C.
D. 1000VρM/(MV+2240)
难度: 中等查看答案及解析
-
用25mL18.4mol/L的浓硫酸与铜共热一段时间后,冷却,过滤除去多余的铜,将滤液稀释到100 mL,所得溶液中SO42-浓度为3mol/L,则此时溶液中CuSO4的物质的量浓度为
A. 0.5mol/L B. 1.6 mol/L C. 1.8 mol/L D. 3mol/L
难度: 中等查看答案及解析
-
将一定量的镁与100 mL 18.5 mol/L浓硫酸充分反应后,镁完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的c(H+) = 0.1 mol/L,则下列叙述中错误的是
A. 反应中共转移电子3 mol B. 反应中共消耗镁 36 g
C. 气体A中SO2与H2的体积比为3:1 D. 气体A为SO2和H2的混合物
难度: 困难查看答案及解析