-
下列微粒中半径最小的( )
A. Na+ B.Al3+ C.K+ D.S2-
难度: 中等查看答案及解析
-
下列不能用于比较非金属元素的非金属性强
弱的是( )
A、单质间的置换反应 B、气态氢化物的稳定性
C、单质在水中的溶解度的大小 D、最高价氧化物对应水化物的酸性强弱
难度: 中等查看答案及解析
-
A、B两种元素,A的原子序数为a,如果A和B同在ⅣA族,当B的周期数大于A的周期数时, B的原子序数不可能为( )
A.a+2 B.a+8 C.a+26 D.a+18
难度: 简单查看答案及解析
-
下列情况会破坏共价键的是 ( )
A.硫化钠加热融化 B.二氧化碳溶于水
C.蔗糖溶于水 D.氢氧化钠溶于水
难度: 中等查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是
A、酸性:H2SO4>HClO
B、非金属性:Cl>Br
C、碱性:NaOH>Mg(OH)2
D、热稳定性:NH3>CH4
难度: 简单查看答案及解析
-
下列关于化学反应与能量的说法正确的是
A.燃烧反应不一定是放热反应
B.化学反应一定既有物质变化又有能量变化
C.反应物断键所吸收的总能量高于生成物形成键所放出的总能量的反应为放热反应
D.反应物所具有的总能量高于生成物所具有的总能量的反应为吸热反应
难度: 简单查看答案及解析
-
已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1
② 2CO (g)+ O2(g)=2CO2(g) ΔH2
③ H2O(g)=H2O(l) ΔH3
下列叙述正确的是: ( )
A.CH3OH(l)的燃烧热是|ΔH1/2|
B.CO的燃烧热是|ΔH2/2|
C.CH3OH(l)+O2(g)= CO(g) + 2H2O(l)ΔH =ΔH1-ΔH2+4ΔH3
D.ΔH3>0
难度: 简单查看答案及解析
-
已知可逆反应2SO2 + O2
2SO3,当生成1 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则( )
A.Q1 < Q B.Q1 = Q C.Q1 > Q D.无法判断
难度: 简单查看答案及解析
-
下列说法正确的是( )
A 活化分子的每一次碰撞都能够发生化学反应
B 反应物用量增加后,有效碰撞次数增多,反应速率增大
C 能够发生有效碰撞的分子叫做活化分子
D 加入催化剂对化学反应速率无影响
难度: 中等查看答案及解析
-
关于A(g) + 2B(g)
3C(g)的化学反应,下列表示的反应速率最大的是
A.v(A) = 0.6 mol/(L·min) B.v(B) = 1.2 mol/(L·min)
C.v(C) = 1.2 mol/(L·min) D.v(B) = 0.03 mol/(L·s)
难度: 简单查看答案及解析
-
实验室有下列各组反应物,放出氧气速率由快到慢排列正确的是
①0.2mol/L的H2O2溶液,25℃ ②0.2mol/L的H2O2溶液,MnO2,25℃
③0.
2mol/L的H2O2溶液,35℃ ④0.2mol/L的H2O2溶液,MnO2,35℃
A.①②③④ B.④③②① C.②①③④ D.④②③①
难度: 简单查看答案及解析
-
在2 L的密闭容器中发生反应:2SO2 + O2
2SO3,如果2 min内SO2的量由12 mol下降为4 mol,则下列说法正确的是
A.用SO2的浓度变化表示的反应速率为4 mol/(L·min)
B.用O2的浓度变化表示的反应速率为2 mol/(L·min)
C.增大压强,正反应速率增大,逆反应速率减小
D.升高温度,正反应速率和逆反应速率都增大
难度: 中等查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量随反应时间的变化曲线如图,下列表述中正确的是( )

A、反应的化学方程式为:2M
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
难度: 中等查看答案及解析
-
下列叙述中说明某化学平衡一定发生移动的是
A.混合体系中气体密度发生变化
B.正、逆反应速率改变
C.混合物中各组分的浓度改变
D.反应物的转化率改变
难度: 中等查看答案及解析
-
下列事实可用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.硫酸工业中,将黄铁矿粉碎后加入沸腾炉中
C.500℃左右比在室温时更有利于提高合成氨的转化率
D.对2HI
H2+I2平衡体系增加压强使颜色变深
难度: 中等查看答案及解析
-
对于可逆反应:2A(g)+B(g)
2C(g) ΔH<0,下列各图正确的是


难度: 简单查看答案及解析
-
将1molN2和3molH2进行合成氨试验后,测得反应后混合气体(N2、H2和NH3)的平均摩尔质量为10.2g·mol-1,则N2的转化率约为
A.18% B.20% C.25% D.33%
难度: 困难查看答案及解析
-
在一容积可变的密闭容器中,aA(气)
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则:
A.平衡向逆反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.化学计量数关系a>b
难度: 简单查看答案及解析
-
在体积不变的绝热密闭容器中,2molSO2与1molO2在催化剂作用下发生反应:2SO2(g)+O2(g)
2SO3(g)△H=﹣QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述错误的是( )
A.增大氧气浓度,平衡正向移动,平衡常数不变
B.降低温度,正反应速率比逆反应速率减小的程度小
C.平衡时SO2气体的转化率为50%
D.该条件下反应放出0.5QkJ的热量
难度: 中等查看答案及解析
-
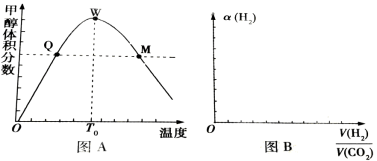
可逆反应mA(s)+nB(g)
pC(g)在一定条件下达到平衡后,改变压强,B的体积分数φ(B)与压强的关系如图所示,有关叙述正确的是( )。
A.m+n<p
B.n>p
C.X点时v(正)>v(逆)
D.X点比Y点的正反应速率快
难度: 中等查看答案及解析
-
W、X、Y、Z均为的短周期主族元素,原子序数依次增大,且原子核外L电子层的电子数分别为0、6、8、8,它们的最外层电子数之和为20。下列说法正确的是( )
A.氢化物的沸点:Y>X
B.阴离子的还原性:Y>Z
C.氧化物的水化物的酸性:Y<Z
D.X与Y不能存在于同一离子化合物中
难度: 简单查看答案及解析
-
参照反应Br+H2
HBr+H的能量对反应历程的示意图,下列叙述正确的是
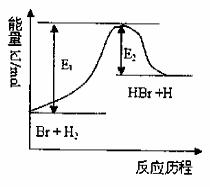
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量低于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
难度: 简单查看答案及解析
-
反应3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.保持体积不变,增加H2O(g)的物质的量
B.将容器的体积缩小一半
C.保持体积不变,充入Ar使压强增大
D.保持压强不变,充入Ar使体积增大
难度: 简单查看答案及解析
-
利用催化技术可将汽车尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO
2CO2+ N2。某温度下,在容积不变的密闭容器中通入NO和
CO,测得不同时间的NO和CO的浓度如下表:
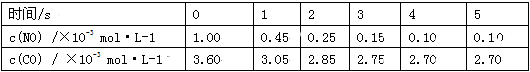
下列说法中,不正确的是
A.2s内的平均反应速率υ(N2)=1.875×10-4 mol·L-1·s-1
B.在该温度下,反应的平衡常数K=15
C.若将容积缩小为原来的一半,NO转化率大于90%
D.使用催化剂可以提高单位时间CO和NO的处理量
难度: 中等查看答案及解析
-
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)
CH3OH(g)。一定条件下,将0.5molCO和0.5molH2在体积为2L的密闭容器中发生上述反应,则下列示意图合理的是 ( )

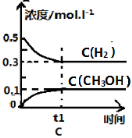

难度: 困难查看答案及解析