-
下列化学用语表示正确的是( )
A. 乙烯的结构简式:CH2CH2 B. S2-的结构示意图:
C. 中子数为20的氯原子:35Cl D. 羟基的电子式:
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. c (H+):c (OH-)=1012 的溶液中:NH4+、Al3+、NO3-、Cl-
B. pH =7溶液中:K+、Fe3+、SO42-、H+
C. 遇甲基橙变黄色的溶液中:Fe2+、NO3-、SO42-、Na+
D. 由水电离的c (H+)=1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A. MnO2固体与浓盐酸反应制取Cl2:MnO2+4HCl
Mn2++2Cl-+Cl2↑+2H2O
B. AlCl3溶液中滴加浓氨水至过量:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O
D. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3-
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下不能实现的是
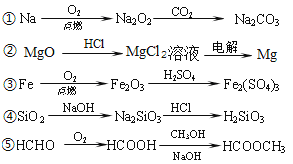
A. ①②③ B. ②③④ C. ②③⑤ D. ①④⑤
难度: 中等查看答案及解析
-
下列实验能达到预期目的的是( )
实验内容
实验目的
A
测同温同浓度下的Na2CO3和Na2SO3水溶液的pH
确定碳和硫两元素非金属性强弱
B
向1ml 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀
可以证明在相同温度下,溶解度Mg(OH)2>Fe(OH)3
C
将NaOH溶液滴入该溶液中加热,放出的气体能使湿润的红色石蕊试纸变蓝
证明溶液中有NH4+
D
用稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色
证明氧化性:H2O2比Fe3+强
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述中正确的是( )
A. 0.1mol-NH2(氨基)中含有的电子数目为0.9NA
B. 常温下,1L 0.1mol/L CH3COONa溶液中含有的CH3COO-和Na+总数为0.2NA
C. 16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
难度: 中等查看答案及解析
-
甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系:
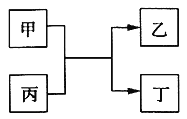
下列说法正确的是( )
A. 若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si
B. 若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物
C. 若甲为金属单质,乙为非金属单质,则甲只能是Mg
D. 若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2
难度: 困难查看答案及解析
-
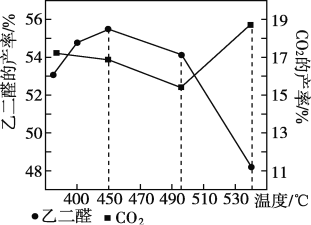
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的HCO3-、CO32-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )
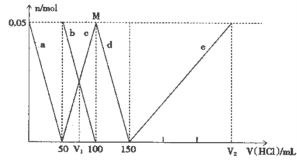
A. 原混合溶液中的CO32-与AlO2-的物质的量之比为1:2
B. V1:V2=l:5
C. M点时生成的CO2为0.05mol
D. e曲线表示的离子方程式为: Al(OH)3+3H+= Al3++3H2O
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,常见金属元素Z的一种核素的质量数为28,中子数比质子数多2。下列说法中正确的是( )
A. 用“百度”搜索知,Y、Z形成的化合物“室温下强度高,……。导热性好,热膨胀系数小,是良好的耐热冲击材料。”由此可推测该化合物属于离子晶体
B. 化合物YW3水解产物之一具有强氧化性,由此可知Y在该化合物中的化合价为+3
C. 由非金属元素组成的化合物YX5是一种是否存在尚待确证的化合物,假如存在,该物质与水反应必然生成气体X2,同时得到一种弱碱溶液
D. 因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取
难度: 中等查看答案及解析
-
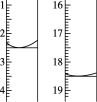
亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生。它的部分性质见右图,下列说法错误的是
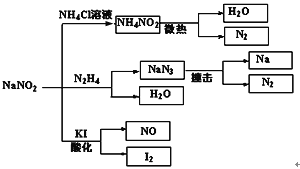
A.可用淀粉碘化钾试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2)
B.N2H4极易溶于水,因为它是极性分子且与水分子之间易形成氢键
C.NaNO2与N2H4生成NaN3的反应方程式为:NaNO2+N2H4 = NaN3 + 2H2O
D.上图所涉及到的化学反应都是氧化还原反应
难度: 中等查看答案及解析
-
下列关于有机物的说法中,正确的一组是( )
①淀粉、油脂、糖类、蛋白质在一定条件下都能发生水解反应
②“乙醇汽油”是在汽油中加入适量乙醇而成的一种燃料,它是一种新型化合物
③除去乙酸乙酯中残留的乙酸,加过量饱和碳酸钠溶液振荡后,静置分液
④石油的分馏和煤的气化均发生了化学变化
⑤淀粉水解的最终产物在加热条件下能与新制Cu(OH)2悬浊液发生反应
⑥除去CH4中的少量C2H4:通过盛有溴水的洗气瓶
A. ①②⑤⑥ B. ①②④⑤ C. ③⑤⑥ D. ③④⑤⑥
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 有机物的同系物具有相同的通式,且组成相差n(n>0的正整数)个CH2原子团,因此等质量的同系物完全燃烧时消耗氧气的物质的量相差1.5nmol
B. 根据卤代烃的消去反应一定能判断卤代烃中所含卤素原子的种类
C. 饱和一元醇可在一定条件下与氢卤酸发生取代反应
D. 分子式为C7H16的有机物中有三种不同化学环境的氢原子,此有机物一定是2,4―二甲基戊烷或3,3―二甲基戊烷
难度: 中等查看答案及解析
-
下列化合物中与自身类别相同的同分异构体数目(不考虑立体异构)最多的是( )
A. 戊烷 B. 戊醇 C. 戊烯 D. 戊炔
难度: 中等查看答案及解析
-
某有机物是药物生产的中间体,其结构简式如图。下列有关叙述不正确的是( )
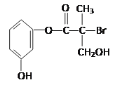
A. 该有机物与浓溴水可发生取代反应
B. 1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH
C. 该有机物与浓硫酸混合共热可发生消去反应
D. 该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀
难度: 简单查看答案及解析
-
将 4 mol A 气体和 2 mol B 气体在 2 L 的定容容器中混合并在一定条件下发生如下反应 2A(g)+B(g)
2C(g) △H<0 ,经 2 s(秒)后测得 C 的浓度为 0. 6 mol·L-1 ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1•s-1
② 达到平衡状态时,升高温度,则该化学平衡向左移动,同时化学平衡常数K也减小
③ 2 s 时物质 A 的转化率为70%
④ 达到平衡状态时,增加A物质的量,A和B转化率都提高
⑤当各物质浓度满足c(A)=2c(B)= c(C)时,该反应达到了平衡状态
其中正确的是( )
A. ①③ B. ①② C. ②③ D. ③④
难度: 中等查看答案及解析
-
25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是( )
A. 在0.1 mol·L-1Na2S溶液中:2c(Na+) =c(S2-)+c(HS-) +c(H2S)
B. pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+ c(H+)= c(OH-)+c(CH3COO-)
C. 向0.1mol·L-1盐酸与0.1mol·L-1K2CO3溶液等体积混合:c(K+)>c(HCO3-)>c(Cl-)>c(OH-)>c(H+)
D. 向0.1 mol·L-1 NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-) =c(H+)
难度: 中等查看答案及解析
-
还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:

已知转化过程中的反应为2CrO42-(aq)+2H+(aq)
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是( )
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
难度: 简单查看答案及解析
-
用酸性氢氧燃料电池电解硫酸钠饱和溶液的装置如图所示(a、b为铜电极)。下列说法中不正确的是( )

A. 电池工作时,正极反应式为:O2+4H++4e-=2H2O
B. 电解时,当阴极逸出a mol气体,同时有W克Na2SO4•10H2O 析出,保持温度不变,剩余溶中的硫酸钠的质量分数是
C. 电解时,电子流动路径是:负极→外电路→阴极→阳极→正极
D. 若忽略能量损耗,当电池中消耗0.01mol O2 时,b 极周围会产生0.02mol H2
难度: 中等查看答案及解析