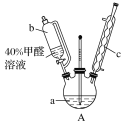
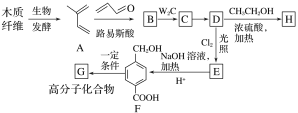
-
下列说法正确的是
A. 分子式为C4H8O2的有机物共有5种
B. 蛋白质在酶等催化剂作用下水解可得到氨基酸
C. 乙烷、氯乙烷、二氯乙烷互为同系物
D. 植物油中不可能含有碳碳双键
难度: 中等查看答案及解析
-
下列分析不正确的是
A. “木与木相摩则然(燃)”的“然”是化学能转变为热能
B. “司烜氏,掌以夫遂(青铜凹镜)取明火于日”的“夫遂”是单质
C. “著作酒醴(甜酒),尔惟曲蘖(酒曲)”的“曲蘖”是催化剂
D. “浮梁巧烧瓷,颜色比琼玖”的“瓷”是硅酸盐产品
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列有关叙述正确的是
A. 常温常压下,1.8g甲基(—CD3)中含有的中子数为NA
B. 2.3g钠被O2完全氧化时,钠得到的电子数目为0.1NA
C. 9.2 g甲苯被酸性KMnO4氧化生成苯甲酸时,反应中转移电子数为0.6NA
D. 常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10−9NA
难度: 中等查看答案及解析
-
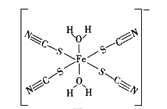
下列说法正确的是
A. 检验(NH4)2Fe(SO4)2·6H2O晶体中的NH4+:取少量晶体溶于水,加入足量浓NaOH溶液并加热,再用湿润的蓝色石蕊试纸检验产生的气体
B. 验证FeCl3与KI反应的限度:可将少量的FeCl3溶液与过量的KI溶液混合,充分反应后用CCl4萃取,静置,再滴加KSCN溶液
C. 受溴腐蚀致伤时,先用稀NaOH溶液洗,再用水洗
D. 用激光笔检验硫酸铜溶液具有丁达尔效应
难度: 中等查看答案及解析
-
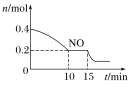
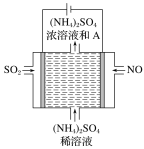
空气污染物NO通常用含Ce4+的溶液吸收,生成HNO2、NO3-,再利用电解法将上述吸收液中的HNO2转化为无毒物质,同时生成Ce4+,其原理如图所示。下列说法正确的是
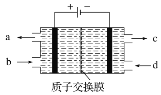
A. H+由右室进入左室
B. Ce4+从电解槽的c口流出,且可循环使用
C. 阴极的电极反应式:2HNO2+6H++6e-===N2↑+4H2O
D. 若用甲烷燃料电池作为电源,当消耗标准状况下33.6 L甲烷时,理论上可转化2mol HNO2
难度: 困难查看答案及解析
-
短周期主族元素X、Y、Z、W的原子半径依次增大,且原子最外层电子数之和为15,Y是地壳中含量最高的元素,Y与Z同主族,Z与W同周期。下列说法正确的是
A. 简单氢化物的还原性:Y>Z
B. Z的简单离子与W的简单离子具有相同的电子层结构
C. 化合物WX2中既存在离子键,又存在共价键
D. X与Y形成的化合物可能使酸性KMnO4溶液褪色
难度: 中等查看答案及解析
-
已知298 K时,Ksp(NiS)=1.0×10−21,Ksp(NiCO3)=1.0×10−7;p(Ni)=-lgc(Ni2+),p(B)=-lgc(S2−)或-lgc(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是
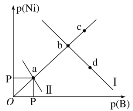
A. 常温下NiCO3的溶解度大于NiS的溶解度
B. 向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C. 对于曲线Ⅰ,在b点加热,b点向c点移动
D. P为3.5且对应的阴离子是CO32—
难度: 中等查看答案及解析